作者:李萌
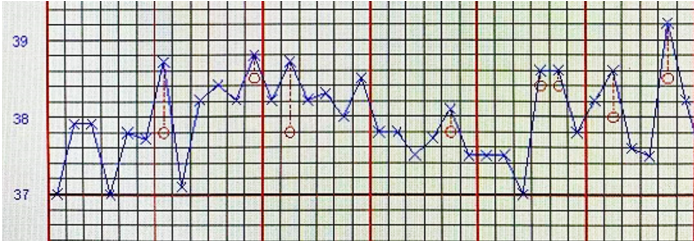
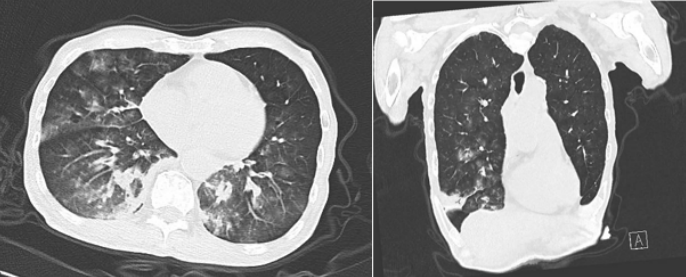
患者,男性,81岁,鼻骨骨折后呛咳4 d,因呼吸困难而入院。Tmax 39.2℃(图1),WBC 7.25×109/L,NEU% 85.5%。既往诊断2型糖尿病10年、帕金森病6年。入院一段时间后,BALF及痰培养结果均显示“肺炎克雷伯菌”。患者胸部CT也符合肺炎克雷伯菌感染特征(图2)。
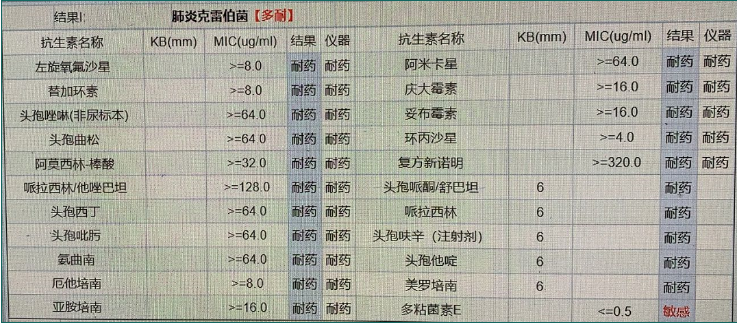
mNGS提示BALF中检出肺炎克雷伯菌(序列数608324)。药敏试验提示广泛耐药的CRE,对替加环素的最低抑菌浓度(MIC)较高,对绝大部分抗生素都耐药,仅对多黏菌素E敏感(图3)。
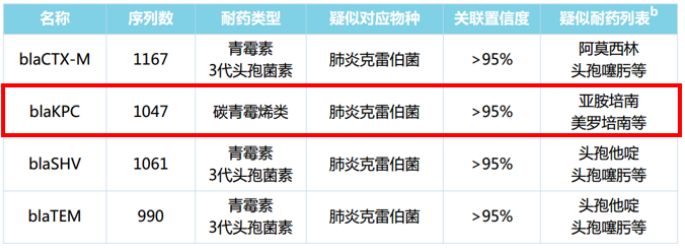
在耐药基因列表中(图4),blaCTX-m、blaSHV、blaTEM均属于超广谱β-内酰胺酶范畴,KPC酶属于碳青霉烯酶,该病原体为产碳青霉烯酶的肺炎克雷伯菌。临床治疗中,根据文献及指南,若KPC(+),首选头孢他啶-阿维巴坦治疗【头孢他啶-阿维巴坦是一种新型抗生素,适用于部分CRE】。因此,该患者随即使用头孢他啶-阿维巴坦治疗,但4 d后,症状仍未见明显好转,甚至体温还升高至39.2℃。为什么原本的特效药反而治疗没有效果?看似波澜不惊的抗感染治疗之下,暗地里充斥着汹涌的暗流!
上述mNGS报告中给出了4种耐药基因,其中3个是ESBL类,1个是KPC类。对于CRE而言,KPC酶占大多数,但如果是金属酶,单用头孢他啶-阿维巴坦是无效的。因此,考虑是否存在金属酶未被检出。随后我们采用胶体金法进行了酶型验证。在六种临床常见的CRE酶型中—NDM、KPC、OXA-23、OXA-48、VIM、IMP,证实仅KPC酶阳性,但也发现其对头孢他啶-阿维巴坦的抑菌圈确实较小,既往该抑菌圈直径多超过25 mm,但此次抑菌圈直径仅有18 mm(图5),处于耐药水平。
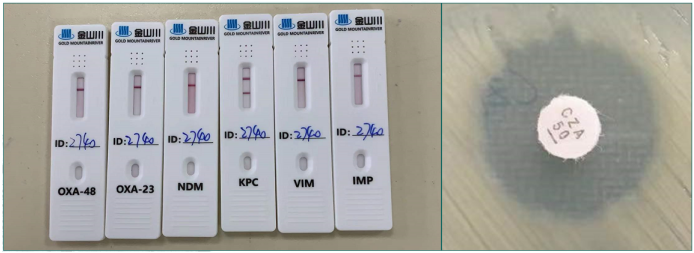
图5 胶体金法进行酶型验证
药敏试验操作介绍
首先,在药敏试验培养基上涂布满细菌,然后再放入药敏纸片,每一张药敏纸片上有一种特定的抗菌药物,药敏纸片会吸收培养基中的水分,其中的抗生素就能溶解到水中,并由纸片中心向纸片外周扩散,距离纸片中心越近,药物浓度越高,距离纸片中心越远,药物浓度就越低,直至药物浓度无法抑制细菌生长时,表观上就会形成一个抑菌圈,圈内没有细菌,圈外都是细菌。抑菌圈的直径直接反映了这种细菌对某种特定药物的敏感度,抑菌圈直径越大,说明该药物对该细菌的抑制作用越强。
存在抑菌圈,未必代表敏感。在美国临床实验室标准化协会(Clinical and Laboratory Standards Institute,CLSI)标准中提到,以氨苄西林为例,不仅要有抑菌圈,而且抑菌圈直径要达到17 mm才能判定为敏感。对于头孢他啶-阿维巴坦而言,抑菌圈直径>21 mm才是敏感,直径≤20 mm是耐药。该菌株抑菌圈直径为18 mm,属于耐药情况。经全基因组序列分析证实该菌株为ST11(Sequence type 11)型肺炎克雷伯菌。目前国内的CRKP中,该菌处于优势地位[1],大多数ST11感染与侵入性装置/操作、免疫低下、老龄等因素相关[2]。本株ST11集“三高”:高毒力、高传播性和高耐药性为一体,全基因组分析见图6。

高毒力:携带iucABCD-iutA及rmpA2基因,携带该基因的菌株可表现出对小鼠的高致死性[3]。高传播性:与其他菌株相比,ST11本身在ICU具有更强的存活率,且可在侵入性设备/装置上定植,伺机感染人体[4]。高耐药性:发现携带至少23种耐药基因,几乎涉及所有常见抗生素;携带ArnA基因,可介导多黏菌素类的耐药;携带AcrA/B、tetA/C共四种可介导替加环素耐药基因;产KPC-2碳青霉烯酶,未发现存在变异。本株ST11 CR-KP对β-内酰胺类可能耐药机制:具备同时产生KPC酶及超广谱内酰胺酶(Esbls)的能力,同时观察到blaKPC-2基因存在高水平表达,意味着下游产物的表达也可能存在同步增高,于是我们推测该菌株其实没有特别复杂的耐药机制,而是采用了一种曾被文献报道过的“大力出奇迹”的方式,通过产酶量的增多,以「饱和攻击」的方式稀释了阿维巴坦的抑制能力[5]。好比我手上有一把枪,每秒钟射出一发子弹,每发子弹都能打死一个敌人。但如果我的对面,一秒钟冲上来10个敌人,甚至20个、30个敌人,那会发生什么?我可能只能消灭冲在前面的那几个敌人,然后就被潮水一般涌上来的敌人所淹没。那么应该如何应对细菌这种“酶海战术”呢?细菌可以“饱和攻击”抗生素,我们也可以“饱和攻击”甚至“过饱和攻击”细菌嘛~~~要营造这种饱和状态,最简单的方法就是直接提高抗生素的用量,但如果单纯提高头孢他啶-阿维巴坦的用量,就会带来另外一个问题:这种抗生素比较昂贵,如果单纯地加大用量,那么可能最终压垮患者的不是感染问题,而是经济压力。面对看似难以两全的局面,怎么办?我们开了一个很大的脑洞:能不能利用其他便宜的β-内酰胺类药物来消耗过多的β-内酰胺酶,减轻酶抑制剂的压力?于是我们设计了一个联合药敏试验:以酶抑制剂为核心,联合其他β-内酰胺类抗生素。我们测试了头孢他啶-阿维巴坦分别联合氨曲南、美罗培南、亚胺培南、头孢呋辛、头孢他啶、头孢曲松、头孢吡肟、头孢哌酮-舒巴坦等β-内酰胺类抗生素的效果,果不其然,在体外试验中均体现了程度不等的协同效果;同时也发现与环丙沙星(代表喹诺酮类)、米诺环素(代表四环素类)、阿米卡星(代表氨基糖苷类)均未体现协同作用(图7)。
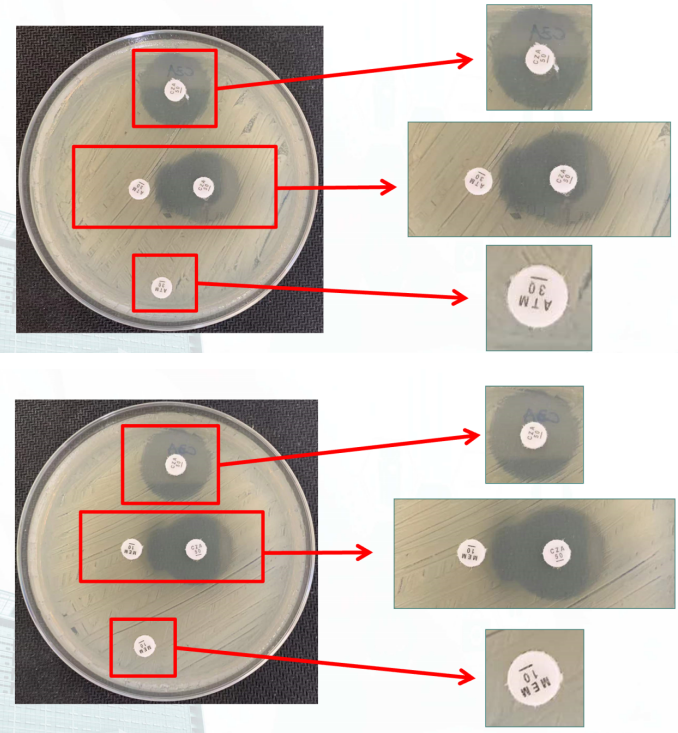

我们将这些重要发现总结了一下,告知了临床的小伙伴们:首先,需要一个酶抑制剂作为核心,该核心需要同时兼顾KPC酶及ESBLS酶;然后,在这个核心之外,至少应联合上述任何一种β-内酰胺类抗生素;此外,除特殊杀菌机制的抗生素(如头孢地尔、多黏菌素)外,不建议联合非β-内酰胺类抗生素。
根据我们提供的实验室证据,临床的小伙伴们接受了我们的建议。于2月22日开始联合用药,方案为头孢他啶-阿维巴坦+氨曲南。患者体温得到明显控制,炎症指标明显下降(CRP由118.36 mg/L降至4.13 mg/L,PCT由0.782 ng/ml降至0.171 ng/ml)。除实验室指标明显好转外,患者的BALF性状也明显改善(图8),未联合用药之前,2月21日送检的BALF呈黄绿色黏稠状,联合用药后48 h,BALF为稀薄的白色半透明状,是肉眼可见的改善。

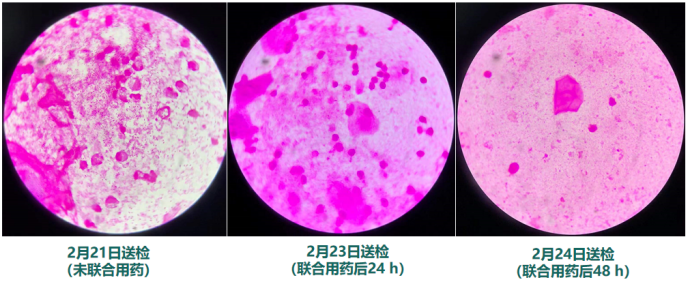
那么肉眼不可见的改善呢?未联合用药前,BALF镜检可见大量肺炎克雷伯菌(++++)以及白细胞(++);联合用药后仅仅24 h,虽然白细胞仍为(++),但细菌几乎消失殆尽;联合用药后48 h,白细胞也大大减少,而细菌完全见不到了(图9)。
我们在培养基上也观察到了类似的现象,未联合用药前,培养基上长满了细菌,联合用药后24 h,细菌数量锐减;联合用药后48 h,这个多重耐药的肺炎克雷伯菌已经完全被压制了(图10)。
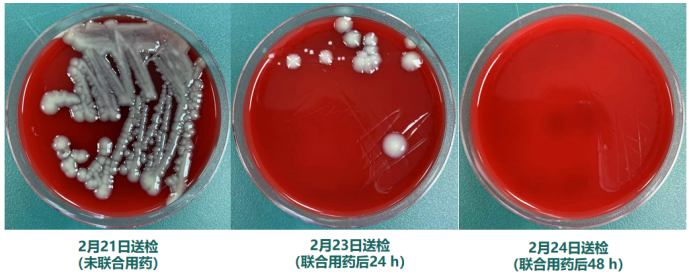
图10 培养结果变化
mNGS检出耐药基因是否等同于耐药?事实上,两者不能完全划等号。例如,当标本中存在多种细菌时,mNGS目前尚无法将耐药基因与特定的细菌一一对应;或者,即使存在耐药基因,也可能不被表达(如甲基化);再者,耐药基因的突变或者产酶量的增多也可能导致抗菌药物敏感性的变化。mNGS报告精准地预报了KPC酶及其他β-内酰胺酶的存在,但有时候老革命也会遇到新问题,细菌太狡猾了,它们会进化出一些我们难以预料的机制来逃避抗生素的打击。mNGS是感染尤其疑难感染检测的一大利器,随着技术进步,mNGS也不再局限于单纯的诊断职能,而是可同时报告多种耐药基因,为进一步的治疗奠定基础;但mNGS目前仍不能提供可靠的药敏信息,需要与传统微生物方法进行协同与补充。“互补不代替,协同不对立,服务于患者,共唱一台戏”。我们常常说:三角形是最稳定的结构。其实在临床抗感染领域,也有这么一个三角形,三角形的三个顶点分别是临床医生、临床微生物检验工作者及药学同仁。在未来,希望我们能够同心协力将抗感染事业推向前进,让这样的MDT团队永远成为患者绝望时的窗、流离时的房、风雨中的伞、黑夜中的光!

[1] Liao W, Liu Y, Zhang W. Virulence evolution, molecular mechanisms of resistance and prevalence of ST11 carbapenem-resistant Klebsiella pneumoniae in China: A review over the last 10 years[J]. J Glob Antimicrob Resist, 2020, 23:174-180.
[2] Zhang X, Zhao Y, Wu Q, et al. Zebrafish and Galleria mellonella: models to identify the subsequent infection and evaluate the immunological differences in different Klebsiella pneumoniae intestinal colonization strains[J]. Front Microbiol, 2019, 10:2750.
[3] Karlsson M, Stanton R A, Ansari U, et al. Identification of a Carbapenemase-Producing Hypervirulent Klebsiella pneumoniae Isolate in the United States[J]. Antimicrob Agents Chemother, 2019, 63(7):e00519-19.
[4] Zhang Y, Jin L, Ouyang P, et al. Evolution of hypervirulence in carbapenem-resistant Klebsiella pneumoniae in China: a multicentre, molecular epidemiological analysis[J]. J Antimicrob Chemother, 2020, 75:327-336.
[5] Shen Z, Ding B, Ye M, et al. High ceftazidime hydrolysis activity and porin OmpK35 deficiency contribute to the decreased susceptibility to ceftazidime/avibactam in KPC-producing Klebsiella pneumoniae[J]. J Antimicrob Chemother, 2017, 72(7):1930-1936.

李萌副主任技师,广西医科大学第一附属医院检验科
中国微生物协会临床微生物专业委员会委员
中日医学科技交流协会检验医学分会委员
全国细菌耐药监测学术委员会青年委员会委员
国际人与动物真菌学会(ISHAM)会员
广西医师协会检验医师分会委员兼秘书
广西医学会检验学分会青年委员会委员
广西科协“科学传播专家”
本文仅用于学术内容的探讨和交流,不用于任何商业和推广,亦不作为最终的临床决策。临床实践需根据患者的具体情况选择适宜的处理措施。
 后可发表评论
后可发表评论




 公众号
公众号
 客服微信
客服微信