登录方式
方式一:
PC端网页:www.rccrc.cn
输入账号密码登录,可将此网址收藏并保存密码方便下次登录
方式二:
手机端网页:www.rccrc.cn
输入账号密码登录,可将此网址添加至手机桌面并保存密码方便下次登录
方式三:
【重症肺言】微信公众号
输入账号密码登录
注:账号具有唯一性,即同一个账号不能在两个地方同时登录。
作者:刘晓姝
侵袭性真菌病(invasis fungal disease,IFD)的诊断分为确诊、临床诊断、拟诊和未确定四个级别[1],针对上述四个级别的治疗策略也各有不同。
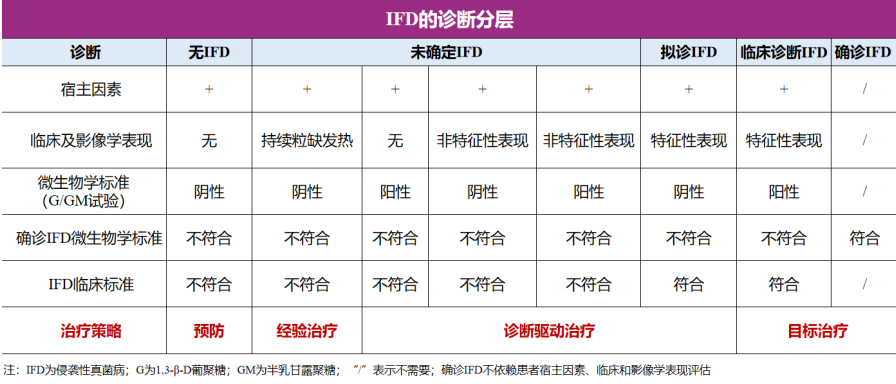
一、侵袭性曲霉病的诊断
无菌部位培养、组织核酸检测是确诊IA的标准[3]。①无菌标本微生物分析:针吸或活检获得标本,进行组织病理学、细胞病理学或直接显微镜检,示菌丝或黑酵母样形态,同时伴随组织损伤证据。②无菌标本培养:从临床或影像学显示的病灶部位(正常无菌部位),通过无菌操作位获取标本,示透明或着色的霉菌。③血:同时存在感染的过程中,血培养示霉菌【注:血培养发现曲霉,多提示污染,此处霉菌不代表曲霉】。④组织核酸诊断:福尔马林固定石蜡包埋组织中发现霉菌时,PCR和DNA测序检测到真菌DNA。
2. 侵袭性曲霉病的临床诊断
临床诊断IA时,患者需符合1项宿主因素、1项临床标准和1项微生物学标准。
(1)宿主因素
①近期发生中性粒细胞缺乏(中性粒细胞计数<0.5×109/L)并持续超过10 d;②接受异基因造血干细胞移植;③既往60 d内,长时间使用皮质类固醇(除外变应性支气管肺曲霉菌病):超过3周的平均最低剂量为0.3 mg/(kg·d)的强的松当量;④既往90 d内接受T细胞免疫抑制剂治疗,如:如环孢素、TNF-α阻滞剂、特定的单克隆抗体(如阿仑单抗)或核苷类似物;⑤遗传性严重免疫缺陷(如:慢性肉芽肿、STAT3基因缺陷或严重联合免疫缺陷);⑥血液恶性肿瘤患者;⑦实体器官移植受者;⑧接受B细胞免疫抑制剂治疗,如布鲁顿酪氨酸激酶抑制剂(如:依鲁替尼);⑨累及肠、肺或肝的Ⅲ级或Ⅳ级移植物抗宿主病,且对一线皮质类固醇治疗无效。
(2)临床标准
①肺曲霉病:影像学表现较为典型,存在以下4种胸部CT特征中的一种:a. 致密、边界清楚的病变,伴或不伴晕征;b. 空气新月征;c. 空洞;d. 楔形和节段性或大叶性实变。②气管支气管炎:镜下可见气管支气管溃疡,结节,伪膜,斑块,或焦痂;③鼻窦感染:a. 急性局部疼痛(包括放射至眼部的疼痛);b. 鼻溃疡伴黑痂;c. 从鼻窦延伸至穿过骨屏障,包括进入眼眶;④中枢神经系统感染:存在以下2种症状中的1种,a. 影像学局灶性病变;b. MRI或CT提示脑膜强化。
IPA的CT影像学有多种表现,从非特征性的气道病变逐渐演变为特征性的血管侵袭为主[4]。曲霉菌侵袭累及肺泡和细支气管壁,影像学可呈现非特征性改变如支气管周围实变影、支气管扩张征、小叶中心型微小结节影、树芽征和磨玻璃样改变等表现,为曲霉菌气道侵袭特征性表现。IPA特征性CT影像学包括:致密、边界清楚的病变(伴或不伴晕征)、空气新月征、空洞、楔形/节段性或大叶性病灶[1]。
IPA患者可出现特征性或非特征性CT改变,且疾病不同阶段CT表现存在一定差异。IPA患者的CT表现与免疫缺陷类型或程度及潜在宿主疾病相关,严重免疫抑制时免疫反应极为有限;而免疫恢复/重建时,反应将增加、病变可能会扩大。边界清晰的病变(结节)是IPA的主要影像学表现;不同影像学表现可能代表疾病的不同阶段[5]。针对免疫缺陷患者,IPA的CT特征随疾病进展而有不同表现:疾病早期以晕轮征为主,随后以空气新月征、空洞常见[6];此外,患者初期病变数量及大小增加,随后进入减少的平稳阶段[7]。
IPA患者还可表现为非特异性和不常见的CT改变,如实变、空洞性病变、胸腔积液、磨玻璃样混浊、树状浸润性病变和肺不张等,但非特异性CT可能会进展为特异性表现。IPA的特异性征象包括:小结节(<10 mm)、树芽征、磨玻璃病变、气腔实变等。病理基础为曲霉菌侵袭气道致气腔内渗出,影像上不具有特异性,细菌、病毒感染均可出现这些征象。真菌感染非特异性征象出现概率较小,其原因可能是机体免疫力提高或抗真菌治疗使病变很快被吸收或迅速进展为血管侵袭期,所以出现时间短。
IPA的特征性影像:①大结节:>10 mm,影像特点:一般双肺多发,形态不规则,边缘毛糙,可有分叶,倾向于中上肺野分布;病理基础:血管侵袭期形成炎性肉芽肿,中心凝固性坏死。②晕征:影像特点为结节周围见模糊淡薄磨玻璃渗出,边界不清。病理基础:病变侵袭血管致血管出血,渗出至结节周围形成“晕征”。渗出短时间内吸收,因此“晕征”出现的时间也较短。③空洞:影像特点为多态结节内出现空洞,部分空洞内见细网状分隔或结节(形成空气半月征)。病理基础:机体免疫力提高或抗真菌治疗有效,菌丝被切断,原本被菌丝抓住的凝固性坏死物质逐渐排出,当部分排出时,空洞内残留部分菌丝及坏死物质,即形成网状分隔;若空洞内残留菌丝及坏死物质形成结节,结节与空洞之间形成“空气半月征”;若坏死物质全部排出即形成空洞。
晕征
空洞
非免疫缺陷患者中IPA的非特征性CT改变同样较为常见,应引起临床关注。气道侵袭性CT症状亦是IPA患者的常见表现,且动态监测有助于早期识别IPA患者。一项对254例成人侵袭性肺曲患者的研究,患者表现为多种血管侵袭症状及多种气道侵袭症状;研究同时发现:非免疫功能缺陷IPA患者中,仅28.9%的患者早期表现为血管侵袭症状,但随疾病进展越来越常见;相对,几乎所有患者在疾病开始时都表现出气道侵袭症状[8]。
(3)微生物学标准
①半乳甘露聚糖抗原(GM):血浆、血清、BALF或脑脊液中检测到抗原,结果为以下任意一项:a. 单次血清或血浆≥1.0;b. BALF≥1.0;c. 单次血清或血浆≥0.7且BALF≥0.8;d. CSF≥1.0;暴露于抗真菌药物会降低IA的敏感性,因此当发现血清或血浆缺少GM时应格外予以注意。②曲霉PCR检测,以下任意一项,a. 血浆、血清或全血连续2次或以上PCR检测阳性;b. BALF重复2次或以上PCR检测阳性;c. 血浆、血清或全血至少1次PCR检测阳性,同时BALF至少1次PCR检测阳性。③痰、BALF、支气管毛刷或抽吸液培养检出曲霉。
传统方法检测IA存在一定局限性,生物标志物已成为临床诊断的主要方法。传统培养技术检测IA的阳性率和敏感率均较低,且较为耗时[9,10],但无菌部位培养阳性仍是诊断IA的标准;因此,无菌部位标本培养具有较高的临床价值,应尽量送检无菌部位的标本。在免疫功能低下患者中,及时检测IA是降低高病死率的关键措施;因此简便快速的检测方法对于临床管理极为重要[11]。既往报道提示:一种检测半乳甘露聚糖(GM)的简易免疫分析法检测曲霉的敏感性和特异性均较高,分别达到80%和93.2%,总检测准确率为89%。因此,GM试验已成为临床诊断IA的重要手段。
血G试验和GM试验在血液病患者IA诊断中具有较高的价值。研究发现:G试验和GM试验诊断IA的敏感性、特异性、阳性预测值和阴性预测值均较高。与血液病患者不同,G试验和GM试验在诊断非血液病患者IA时的敏感性和阳性预测值相对较低,但其特异性及阴性预测值仍较高。
BALF G试验和GM试验则在诊断非血液病患者IA时表现出较高的诊断价值。研究显示:BALF GM试验诊断IA的准确性较高,且与血GM试验结果相当。针对呼吸科等非血液病患者,BALF G试验和GM试验诊断IA时表现出较高的敏感性、特异性、阳性预测值和阴性预测值。
但临床中有多种因素会影响G试验、GM试验结果的准确性。①G试验:a. 假阳性:使用纤维素膜进行血透,标本或患者暴露于纱布或其他含有葡聚糖的材料;静脉输注免疫球蛋白、白蛋白、凝血因子或血液制品;链球菌血症,操作者处理标本时存在污染等。b. 假阴性:非敏感菌,如接合菌(毛霉、根霉等)、隐球菌等;局灶性真菌感染;使用抗真菌药物。②GM试验:a. 假阳性:使用半合成青霉素、免疫球蛋白、血液制品、高剂量肾上腺皮质激素;化疗导致严重黏膜炎;新生儿和儿童;血液透析;自身免疫性肝炎等。b. 假阴性:释放入血液循环中的曲霉GM(包括甘露聚糖)并不持续存在,而是会很快被清除;既往使用抗真菌药物;非重症患者;非粒细胞缺乏患者。
PCR已经成为指南推荐的诊断标准,其检测IA具有较高的敏感性和特异性。近年来,PCR检测血液和BALF已被指南推荐为临床诊断IA的真菌学标准。目前,曲霉PCR检测主要被用于疑似IA患者的确诊或筛查IA高风险人群,以促进早期诊断。一项25项研究的荟萃分析显示:血清PCR检测的敏感性和特异性分别为84%和76%;此外,至少有两次PCR检测结果阳性时的特异性则高达95%,敏感性为64%,高似然比为12.8[12]。17项研究的荟萃分析及系统汇总:BALF PCR检测诊断确诊及临床诊断IA的敏感性和特异性分别达91%和92%;阳性似然比为11.90,阴性似然比为0.10[13]。
近年来,NGS被逐渐用于IA等感染性疾病的诊断。指南明确指出[14]:NGS对真菌的检出率显著高于培养;以临床诊断为金标准,NGS的灵敏度显著高于培养(50.7% vs 35.2%),而二者的特异度无显著区别。对于新发、罕见、疑难的感染性疾病,以及免疫缺陷患者,NGS能显著提高病原体的检出率,可作为上述疾病的一线检测方法。
但NGS用于诊断IA时仍存在一定的局限性[15,16]:①检测的敏感性与人源背景微生物水平相关;②临床标本来源复杂多样,可能存在病原体信息太少而导致数据丢失或数据混杂;③缺乏标准数据及统一的数据分析流程;④数据库的完整性及准确性参差不齐,且检测人员及技术水平对检测结果亦存在影响;⑤NGS技术自身的局限性;⑥多数mNGS检测需在第三方实验室集中进行,样本寄送耗时较长;⑦价格昂贵、基因量少等。
多次生物标志物检测或联合检测在高危患者中筛查IA具有较高的诊断阳性率。一项荟萃分析结果显示:使用至少1个GM试验或PCR阳性结果确定阳性的敏感性高达99%,且结果显著高于任何单一试验(与GM试验相比,P=0.0018;与PCR相比,P<0.0001);此外,当同一患者的GM试验和PCR均为阳性时,其诊断特异性增高至98%。该研究证实:单次GM试验或PCR检测阳性对筛查高危患者的IA效能欠佳,但具有较高的阴性预测值;当至少2次阳性结果时阳性预测值可达88%[17]。
影像学联合微生物学有助于IPA的早期诊断。一项针对141例IPA患儿的回顾性分析:GM联合CT诊断的敏感性、特异性、阳性预测值(PPV)及阴性预测值(NPV)分别为79.3%、85.2%、76.4%和87.2%;且与血清GM检测、CT检查相比,GM联合CT检查的曲线下面积(AUC)最大[18]。一项针对113例成人IPA患者的研究结果显示:GM联合CT诊断的敏感性与单纯GM检测相当,而特异性则明显提升[19]。


参考文献
[1] 中国医师协会血液科医师分会, 中国侵袭性真菌感染工作组. 血液病/恶性肿瘤患者侵袭性真菌病的诊断标准与治疗原则(第六次修订版)[J]. 中华内科杂志, 2020, 59(10):754-763.
[2] 施毅, 赵江南. 侵袭性真菌病病原学非培养实验室诊断方法[J]. 中华结核和呼吸杂志, 2019, 42(7): 500-505.
[3] Donnelly J P, Chen S C, Kauffman C A, et al. Revision and Update of the Consensus Definitions of Invasive Fungal Disease From the European Organization for Research and Treatment of Cancer and the Mycoses Study Group Education and Research Consortium[J]. Clin Infect Dis, 2020, 71(6):1367-1376.
[4] Nucci M, Nouér S A, Cappone D, et al. Early diagnosis of invasive pulmonary aspergillosis in hematologic patients: an opportunity to improve the outcome[J]. Haematologica, 2013, 98(11):1657-1660.
[5] Alexander B D, Lamoth F, Heussel C P, et al. Guidance on Imaging for Invasive Pulmonary Aspergillosis and Mucormycosis: From the Imaging Working Group for the Revision and Update of the Consensus Definitions of Fungal Disease from the EORTC/MSGERC[J]. Clin Infect Dis, 2021, 72(Suppl 2):S79-S88.
[6] Caillot D, Couaillier J F, Bernard A, et al. Increasing volume and changing characteristics of invasive pulmonary aspergillosis on sequential thoracic computed tomography scans in patients with neutropenia[J]. J Clin Oncol, 2001, 19(1):253-259.
[7] Brodoefel H, Vogel M, Hebart H, et al. Long-term CT follow-up in 40 non-HIV immunocompromised patients with invasive pulmonary aspergillosis: kinetics of CT morphology and correlation with clinical findings and outcome[J]. AJR Am J Roentgenol, 2006, 187(2):404-413.
[8] Liu Z, Li Y, Tian X, et al. Airway-invasion-associated pulmonary computed tomography presentations characteristic of invasive pulmonary Aspergillosis in non-immunocompromised adults: a National Multicenter Retrospective Survey in China[J]. Respir Res, 2020, 21(1):173.
[9] 陈林桂,黄怡. 气管镜在侵袭性气管支气管曲霉菌病诊治中的应用价值[J]. 临床肺科杂志, 2018, 23(6):1062-1068.
[10] 陈世敏,罗南萍,公衍文. 血清GM试验和常规真菌检测对肺曲霉菌感染的诊断价值[J]. 放射免疫学杂志, 2013, 26(3):325-327.
[11] Raval K M, Ghormade V, Rajamohanan P R, et al. Development of a nano-gold immunodiagnostic assay for rapid on-site detection of invasive aspergillosis[J]. J Med Microbiol, 2019, 68(9):1341-1352.
[12] Arvanitis M, Ziakas P D, Zacharioudakis I M, et al. PCR in diagnosis of invasive aspergillosis: a meta-analysis of diagnostic performance[J]. J Clin Microbiol, 2014, 52(10):3731-3742.
[13] Sun W, Wang K, Gao W, et al. Evaluation of PCR on bronchoalveolar lavage fluid for diagnosis of invasive aspergillosis: a bivariate metaanalysis and systematic review[J]. PLoS One, 2011, 6(12):e28467.
[14] 中国宏基因组学第二代测序技术检测感染病原体的临床应用专家共识[J] . 中华传染病杂志, 2020, 38(11): 681-689.
[15] Consortium OPATHY; Gabaldón T. Recent trends in molecular diagnostics of yeast infections: from PCR to NGS[J]. FEMS Microbiol Rev, 2019, 43(5):517-547.
[16] 宏基因组学测序技术在中重症感染中的临床应用共识专家组, 中国研究型医院学会脓毒症与休克专业委员会, 中国微生物学会微生物毒素专业委员会,等. 宏基因组学测序技术在中重症感染中的临床应用专家共识(第一版)[J]. 中华危重病急救医学, 2020, 32(5):531-536.
[17] Seo H, Kim J Y, Son H J, et al. Diagnostic performance of real-time polymerase chain reaction assay on blood for invasive aspergillosis and mucormycosis[J]. Mycoses, 2021, 64(12):1554-1562.
[18] Qiu K Y, Liao X Y, Huang K, et al. The early diagnostic value of serum galactomannan antigen test combined with chest computed tomography for invasive pulmonary aspergillosis in pediatric patients after hematopoietic stem cell transplantation[J]. Clin Transplant, 2019, 33(8):e13641.
[19] 许攀峰, 周建英, 周华, 等. 血清抗原检测联合肺部CT诊断侵袭性肺曲霉菌病的探讨[J]. 浙江大学学报(医学版), 2012, 41(3):332-338.
[20] Felton T, Troke P F, Hope W W. Tissue penetration of antifungal agents[J]. Clin Microbiol Rev, 2014, 27(1):68-88.
[21] Herbrecht R, Denning D W, Patterson T F, et al. Voriconazole versus amphotericin B for primary therapy of invasive aspergillosis[J]. N Engl J Med, 2002, 347(6):408-415.
[22] Raad I I, Zakhem A E, Helou G E, et al. Clinical experience of the use of voriconazole, caspofungin or the combination in primary and salvage therapy of invasive aspergillosis in haematological malignancies[J]. Int J Antimicrob Agents, 2015, 45(3):283-288.
[23] Patterson T F, Thompson 3rd G R, Denning D W, et al. Practice Guidelines for the Diagnosis and Management of Aspergillosis: 2016 Update by the Infectious Diseases Society of America[J]. Clin Infect Dis, 2016, 63(4):e1-e60.
作者简介
四川省人民医院呼吸与危重症医学科副主任医师,硕士研究生导师
四川省卫健委学术技术带头人后备人选
四川省医学会呼吸病学专业委员会委员、肺结核学组副组长
四川省预防医学会呼吸系统疾病防治分会常务委员
中国康复医学会重症康复专业委员会委员
四川省康复医学会重症医学专业委员会委员
长期从事呼吸与危重症疾病的诊疗工作,对慢性阻塞性肺疾病、重症肺炎、急/慢性呼吸衰竭等常见呼吸疾病的诊治有丰富的临床经验
【注:本文仅用于学术内容的传播和交流,不用于任何商业和推广】
 后可发表评论
后可发表评论




友情链接
联系我们
 公众号
公众号
 客服微信
客服微信