登录方式
方式一:
PC端网页:www.rccrc.cn
输入账号密码登录,可将此网址收藏并保存密码方便下次登录
方式二:
手机端网页:www.rccrc.cn
输入账号密码登录,可将此网址添加至手机桌面并保存密码方便下次登录
方式三:
【重症肺言】微信公众号
输入账号密码登录
注:账号具有唯一性,即同一个账号不能在两个地方同时登录。
动脉血CO2分压(PaCO2)是反映肺泡通气量大小的可靠指标。PaCO2超过45mmHg即表示存在肺泡低通气(Alveolar hypoventilation)。当PaCO2达到50~70mmHg时,与其相伴的低氧血症可导致红细胞增多、肺动脉高压、肺心病、呼吸衰竭等一系列的病理生理改变及临床症状,称为肺泡低通气综合征(Alveolar hypoventilation syndrome)。多种疾病可引起肺泡低通气,特发性低通气很少见。几乎所有可导致明显高碳酸血症的疾病均伴有睡眠低通气的表现。最近的一项研究表明在体重指数(BMI)大于35 kg/m2的成年住院病人中,31%的人有肥胖低通气综合征[1]。肥胖低通气综合征(Obesity hypoventilation syndrome,OHS)是指肥胖患者(BMI≥30 kg/m2)在除外肺或神经肌肉疾病等其他原因外,在清醒状态下患有高碳酸血症(PaCO2≥45 mm Hg)。其发病机制包括睡眠呼吸紊乱,呼吸驱动力减低以及与肥胖相关的呼吸系统受损等。此类患者的并发症发生率和死亡率均明显增高,并可能出现慢性呼吸衰竭的急性加重,但绝大多数尚未引起医护人员的注意[2]。现报道1例如下,并结合文献对该病例进行讨论。
临床资料
患者,男,25岁。因“夜间打鼾10年余,伴间断意识障碍2周”于2015年6月4日入院。患者10年余前无明显诱因出现睡眠时打鼾,伴呼吸暂停、乏力、嗜睡,并逐渐加重,就诊于北京儿童医院,行睡眠呼吸监测示夜间最低氧饱和度59%,余指标不详,未予特殊诊治。2周前患者因 “肠梗阻”致上述症状加重,并出现昏睡,伴有呼吸困难,体位稍有变化即可出现喘憋、气短;偶有头晕、心悸,同时出现双下肢及阴囊水肿。就诊于我院急诊查血气示:pH 7.25,PaCO2 98mmHg,PO2 37mmHg,SpO2 60%,HCO3- 43.0mmol/L,考虑II型呼吸衰竭,先后予鼻导管吸氧及BiPAP呼吸机辅助通气,期间监测血气PCO2最高达110mmHg。查血白细胞9.26×109/L,中性粒细胞绝对值6.8×109/L,血红蛋白 115g/L,血小板 328×109/L;转氨酶、肌酐正常,白蛋白29.9g/L;24小时尿蛋白3.14g/day,尿蛋白0~++。规律应用BiPAP治疗后嗜睡、低氧逐渐好转。急诊留观期间曾出现咳嗽,胸片示“肺部感染”,先后予“哌拉西林舒巴坦”及“美罗培南”抗感染、静脉营养支持、平喘、化痰等治疗,咳嗽及喘憋症状稍好转,但仍昏睡,为进一步诊治收住我科ICU病房。患者自发病来,无尿频、尿急、腹泻,发病10余年来体重增加约40kg。10年前于儿童医院完善性腺、甲状腺、皮质醇轴等内分泌系统及头颅MRI/CT检查,除外继发因素所致肥胖后诊断为“单纯性肥胖”。10年前诊断“原发性高血压”,血压最高160/90mmhg,应用药物控制。2周前诊断“肥胖相关肾病”,未予特殊诊治。
入院查体
体温:36.8℃,脉搏:90次/分,呼吸:22次/分,血压:130/80mmHg,体重:191kg,身高:172cm,BMI:64.56 kg/m2。体型肥胖,神智清楚,被动体位。双前胸壁,双下肢可见散在斑块状色素沉着,腰部可见小块状破溃。球结膜水肿。口唇紫绀。双肺呼吸音低,双下肺可及散在干湿啰音。心律齐。腹部无压痛、反跳痛,腹肌无紧张。Murphy征阴性,肝脾未触及腹部无包块,双侧肾区无叩痛,腹部听诊欠满意。四肢活动正常,胸壁、腹壁及双下肢呈可凹性水肿。无杵状指(趾)。阴囊水肿,约15×15cm。生理反射正常,肌张力正常,肌力5级。病理反射未引出,Kernig征阴性。
入院时辅助检查
血气分析(BiPAP S/T模式 IPAP 30cmH2O,EPAP 6cmH2O,FiO2 40%):pH 7.42,PCO2 73mmHg,PO2 64mmHg,SpO2 97%,HCO3- 49.3mmol/L;鼻导管低流量吸氧时脉搏氧饱和度80%左右。血常规:白细胞6.80×109/L,中性细胞百分比64.5%,血红蛋白含量104g/L,血小板计数290×109/L。血生化:转氨酶、肌酐正常,白蛋白29.9g/L,钾离子3.99mmol/L,钠离子142.0mmol/L,血糖6.30mmol/L。B型钠尿肽483.0pg/ml。D-二聚体:837ng/mL。超声心动示左房扩大,左室射血分数58%。胸片示双肺纹理增多。腹部、双下肢血管彩超未见异常。肺功能示重度限制性通气功能障碍。
诊疗过程
入院后予BiPAP(S/T模式 IPAP 30cmH2O/ EPAP 6cmH2O FiO2 40%)呼吸机辅助通气,多次复查血气pH 7.36-7.46,PCO2 60mmHg左右、PO2 57-100mmHg;完善皮质醇节律检查未见异常、性腺五项示:促黄体生成素1.15U/L,卵泡刺激素0.51 U/L,血清睾酮0.98nmol/L。治疗上同时控制能量摄入8368kj/d(2000Kcal/d),莫西沙星抗感染及平喘、化痰等治疗,患者神智转清、喘憋消失、水肿明显改善,蛋白尿迅速减少,PCO2逐步下降至40mmHg。2015年6月15日患者转入呼吸科睡眠中心继续治疗,完善呼吸睡眠监测(图28-1及图28-2A)示呼吸暂停低通气指数(AHI)为92次/小时,最长呼吸暂停时间19s,最长低通气时间77s,平均血氧饱和度75.6%,睡眠中最低血氧饱和度41%;结合其重度肥胖、呼吸负荷重,考虑其肥胖低通气诊断明确。
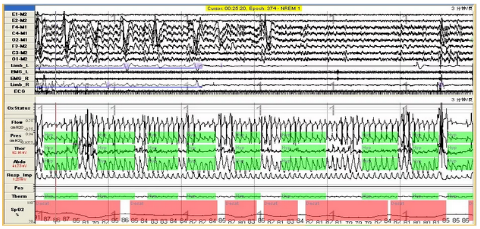
图28-1 患者多导睡眠监测可见频繁阻塞性睡眠低通气
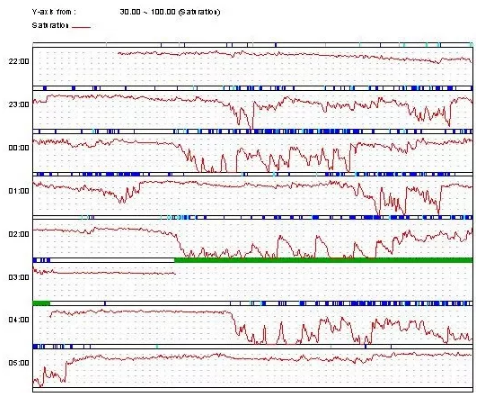
图28-2A 治疗前
此后多次行睡眠脉搏血氧饱和度监测,结合血氧调整BiPAP参数:IPAP 30-36cmH2O,EPAP 6-10 cmH2O;期间维持原有控制热量摄入。最终维持BiPAP参数IPAP 30cmH2O/EPAP 8cmH2O,复查夜间血氧监测(图28-2B)示每小时痒减饱和度4%以上的次数(ODI4)为11.89次/小时,平均血氧饱和度91.1%,最低血氧饱和度69.6%。患者复查血气较前明显改善((静息状态下不吸氧)pH 7.45,PaCO2 78mmHg,PO2 38mmHg,SpO2 96%,HCO3- 27.0mmol/L),水肿基本消失。
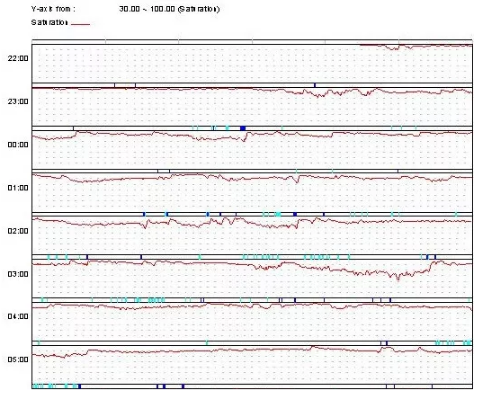
图28-2B 治疗前(A)及治疗后(B)患者夜间血氧饱和度监测
注:SpO2范围30%-100%,图2-B BiPAP治疗参数IPAP 30cmH2O/EPAP 8cmH2O
2015年7月2日患者出院,维持夜间呼吸机治疗。出院1月后患者经控制体重治疗后体重减轻约30Kg,于2015年8月7日复查夜间脉搏血氧饱和度监测(BiPAP参数IPAP 30cmH2O/EPAP 8cmH2O)示ODI4 5.39次/小时,平均血氧饱和度91.3%,最低血氧饱和度80.3%(图28-3)。
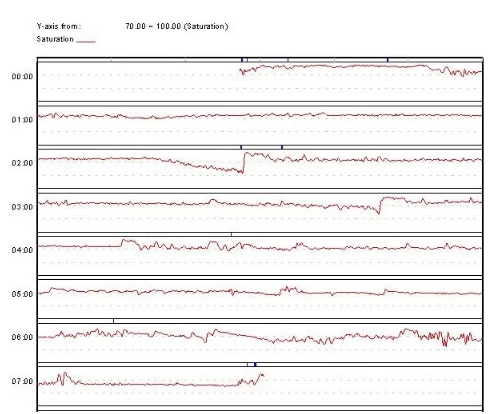
图28-3 治疗1月后患者复查夜间血氧饱和度监测
注:SpO2范围70%-100%,BiPAP治疗参数IPAP 30cmH2O/EPAP 8cmH2O
讨论
近年来肥胖作为一个重要的公共卫生问题,受到了越来越多的关注,在过去的十余年中,肥胖者的比例持续升高,并且出现了越来越多的超级肥胖者(体质量指数BMI≥50 kg/m2)。随着体质量的增加,随之带来的与呼吸系统相关的健康问题越来越多。OHS患者在睡眠呼吸监测中具有共同的特点:反复发生的阻塞性睡眠呼吸暂停(Obstructive sleep apnea,OSA)伴有高碳酸血症。阻塞性睡眠呼吸暂停造成的气流受限引起阻塞性通气不足,这一病理过程贯穿于整个睡眠阶段。未合并日间高碳酸血症的睡眠呼吸暂停或低通气并不属于OHS,但可能是OHS的早期症状,之后很可能会出现慢性二氧化碳潴留[3]。
OHS的发病机制目前仍不十分清楚,可能有以下几方面原因:
呼吸中枢驱动力的变化。重度肥胖者呼吸驱动力增加以维持胸壁正常运动,并消耗更多的呼吸功。但OHS患者入睡后呼吸驱动的减弱、行为性调节功能减弱或消失,低通气加重,尤以非快动眼睡眠的第3、4相降低明显,出现原发性呼吸性酸中毒及继发性碳酸氢盐增加。OHS患者对缺氧及高碳酸血症的通气反应减弱的变化并非受家族遗传因素影响,是后天出现的。
上呼吸道阻塞——睡眠呼吸紊乱。肥胖者颈围增加、上气道狭窄,上气道阻力增加。呼吸暂停低通气是高碳酸血症的独立危险因素,当呼吸暂停时间较长,但恢复正常通气时间较短或者呼吸功能降低,二氧化碳会急性潴留。肾脏碳酸氢盐代偿性增加以缓冲夜间急性二氧化碳潴留,进而引起非睡眠时相机体对二氧化碳敏感性下降,促进日间的低通气的出现。
呼吸功能受损。严重肥胖的患者胸廓和肺的顺应性降低,增加了气道阻力,当补呼气量降低小于肺闭合气量时,出现小气道闭塞和空气陷闭,并导致呼气流量限制和内源性呼气末正压的增加,在仰卧位时这些变化更加显著。
本例患者为25岁青年,超级肥胖者(BMI 64.56 kg/m2)。既往睡眠呼吸监测示夜间最低氧饱和度59%。此次“肠梗阻”后迅速出现水肿、喘憋,血气提示pH 7.25,PaCO2 98mmHg,PO2 37mmHg,SaO2 60%,考虑为慢性呼吸衰竭的急性失代偿表现,经无创通气治疗稳定后完善睡眠呼吸监测示AHI 92次/小时,最长呼吸暂停时间19s,最长低通气时间77s,平均血氧饱和度75.6%,睡眠中最低血氧饱和度41%,符合OHS的临床和实验室检查特征;完善甲状腺功能、肺功能、影像学等检查可除外心脏、肺或神经肌肉疾病等;因此可诊断OSH。OHS患者睡眠时的低通气可导致低氧血症及高碳酸血症,严重者可导致神经内分泌调节功能失衡。低氧血症及高碳酸血症使儿茶酚胺、肾素一血管紧张素、内皮素分泌增加,进而引起血液动力学改变,加重组织器官缺血、缺氧,多系统功能障碍。心、肺、脑血管损害会引起肺动脉高压、肺源性心脏病、心律失常、心绞痛、高血压、心力衰竭等[4]。OHS患者在慢性疾病稳定期及急性加重住院时容易漏诊。与单纯病态肥胖患者相比较,OHS患者的住院率及对医疗保健服务的需求更高。尽管经常与医疗机构接触,但该疾病常被延迟诊断而得不到及时正确的治疗,除非被转诊到专业的睡眠呼吸门诊[5]。
目前治疗OHS的方法主要分为两类:内科治疗,包括无创正压通气以治疗睡眠呼吸紊乱及改善夜间气体交换;外科干预,以促进及维持减肥效果。当上气道阻塞导致慢性高碳酸血症时,单独使用CPAP治疗可纠正日间二氧化碳潴留。在大多数情况下,使用CPAP的第一步是滴定,目标是正常的血氧饱和度,同时夜间二氧化碳不能增高。压力滴定的上限是消除呼吸暂停、低通气、停止打鼾及保持稳定的血氧饱和度,如果仍持续通气不足及二氧化碳持续升高,则需使用双水平正压通气(BiPAP)。在CPAP治疗的第一个晚上,上气道阻塞消除但血氧饱和度不能达到90%者应更换为BiPAP[4]。相当数量的患者初期除需正压通气治疗外,还需要氧疗以保证血氧饱和度大于90%,但一旦建立有效的夜间通气,所需吸氧浓度则会显著降低。本例患者为慢性呼吸衰竭的急性加重,出现严重CO2潴留和失代偿性呼吸性酸中毒,因此治疗上未进行CPAP压力滴定,而是更积极地应用了BiPAP,并且根据动脉血气分析结果提供了较高水平的压力支持,从而纠正了血气和内环境的紊乱。该患者在就诊时积极给予了无创通气支持,充分保证了肺泡通气量,有效纠正了低氧血症和高碳酸血症,避免了气管插管及其并发症。临床稳定后我们第⼀时间完善了睡眠呼吸监测,及时确诊OHS,对远期治疗起到了重要作⽤,也深化了我们对OHS机制及其危害的认识,对以后诊治类似病例也提供了更多的经验。
参考文献
[1].韩芳. 肺泡低通气及低通气综合征.中华结核和呼吸杂志,2014,37(9):648-650.
[2].焦俊,张睢扬,宋云熙. 肥胖低通气综合征. 国际呼吸杂志,2012,32(1):73-78.
[3].Mokhlesi B,Saager I.,Kaw R.Q:Should we routinely screen for hypercapnia in sleep apnea patients before elective noncardiac surgery? Cleve Clin J Med,2010,77:60—61.
[4].Banerjee D,Yee BJ,Piper AJ,et a1.Obesity hypoventilation syndrome:hypoxemia during continuous positive airway pressure. Chest,2007,131:1678—1684.
[5].Mokhlesi B,Kryger MH,Grunstein RR. Assessment and management of patients with obesity hypoventilation syndrome.Proc Am Thorac Soc,2008,5:218 225.
 后可发表评论
后可发表评论




友情链接
联系我们
 公众号
公众号
 客服微信
客服微信