登录方式
方式一:
PC端网页:www.rccrc.cn
输入账号密码登录,可将此网址收藏并保存密码方便下次登录
方式二:
手机端网页:www.rccrc.cn
输入账号密码登录,可将此网址添加至手机桌面并保存密码方便下次登录
方式三:
【重症肺言】微信公众号
输入账号密码登录
注:账号具有唯一性,即同一个账号不能在两个地方同时登录。
作者:胡展维
单位:北京大学第一医院呼吸和危重症医学科
胸膜腔感染是指细菌(包括结核等少见菌)、真菌进入胸膜腔并开始复制所引发的疾病。
肺炎旁积液则是由肺炎或肺脓肿引起的胸腔积液,可分为复杂性和非复杂性两类,其中复杂性肺炎旁积液/脓胸属于难治类型,通常需要机械引流才能治愈。
胸膜腔感染是一种古老的疾病, 早在两千年前, 古希腊医生希波克拉底就曾尝试采用胸腔引流进行治疗, 并指出未引流的胸膜腔感染常导致死亡。青霉素等抗生素的出现曾使感染发生率大幅下降, 但近30年来, 其在全球范围内的发生率又呈上升趋势, 目前仍缺乏国内相关数据。2021年美国Gupta等报道了胸膜腔感染的死亡率在2005—2014年间由4.2%降至2.6%, 而Mummadi等报道胸膜腔感染在院死亡率在2007—2016年间由5.2%增长至6.2%。脓胸患者的死亡率较高, 约有15%的患者死亡, 肺切除术后脓胸的死亡率可以达到28%~50%。
导致胸膜腔感染的主要病因有:①肺炎(最为常见);②结核;③外伤;④其他病灶播散,如食管破裂、膈下脓肿、椎体感染;⑤医源性因素,例如穿刺、置管、术后。
胸膜腔感染的病理生理过程大致分为三个阶段,且部分患者可能出现多期叠加的情况:
(1)渗出期(1期):胸膜腔感染后,脏层和壁层胸膜充血、水肿、渗出,渗出液稀薄,此时若及时治疗,炎症可消退。
(2)纤维沉积化脓期(2期):随着炎症进展,渗液增多,纤维蛋白沉积,脓液变稠,含有大量白细胞、细菌及纤维蛋白,形成纤维素膜(即胸腔镜下所见的分隔),使脓胸趋向局限化。
(3)机化期(3期):若炎症持续,纤维素膜机化形成纤维板,包裹肺组织,限制肺膨胀,导致慢性脓胸。严重影响肺功能,导致肺容积大幅丧失。
胸膜腔感染不同阶段的病理生理改变以及对应的胸水化验和影像学特征见表1。
表1 胸膜感染的病理生理学、诊断发现和治疗策略
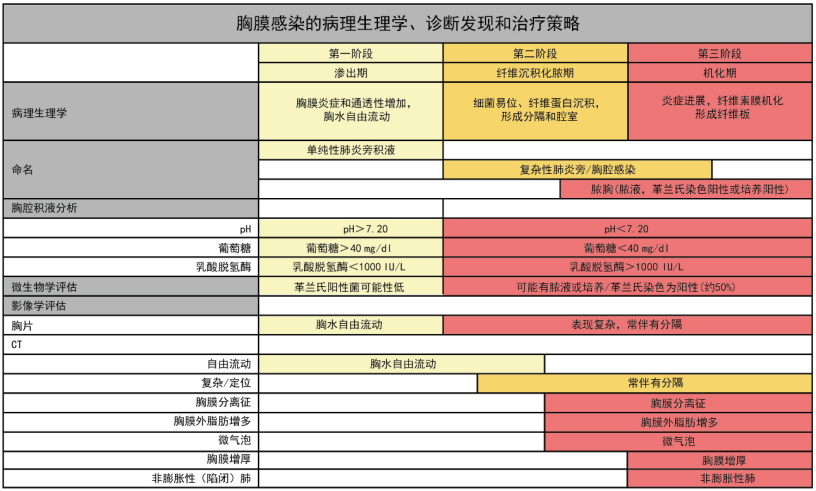
2023年相关数据显示, 全球范围内胸膜腔感染的病原菌按发生率由高到低依次为革兰氏阳性需氧菌、革兰氏阴性需氧菌和厌氧菌。不同地区(热带、亚热带、温带)的病原菌组成存在一定差异。在社区获得性感染中, 革兰氏阳性菌占绝大部分, 而在院内获得性感染中, 革兰氏阴性菌感染概率相对较高, 但革兰氏阳性菌仍占主导地位, 这为脓胸治疗中抗生素的选择提供了参考。
1. 抗生素治疗
对于1期(单纯渗出期,胸水自由流动且pH>7.2)的患者,单纯抗生素治疗可能治愈,无需引流;但2期和3期患者除了予以抗生素治疗外,还必须结合引流治疗,否则感染和脓毒症难以控制;而且2期和3期患者多处于严重炎症和慢性消耗状态,需给予足够的支持治疗。
2. 引流治疗
(1)影像辅助判断:引流是胸膜腔感染治疗的关键和难点,需要借助影像学辅助判断。胸部CT显示的包裹性积液、胸膜明显增厚、胸膜分离征、胸膜外脂肪间隙变厚且强化以及胸腔内小气泡(多见于厌氧菌感染)等均为脓胸的征象。有学者比较了胸部CT和超声在诊断中的价值,结果发现超声的阳性预测值和阴性预测值均高于胸部CT。超声在呼吸危重症领域应用广泛,对于胸膜腔感染,其应用价值也十分突出,且超声具有良好的可及性。超声可识别“浮游生物征”,该征象并非完全无回声的表现,而是存在大量小颗粒样的影像。动态观察时,随着呼吸运动,这些小颗粒会随之移动。这些颗粒样物质可能是脓液、大量蛋白或血液等。因此,"浮游生物征"也是脓胸的征象之一。此外,超声还能清晰显示大量的分隔情况,这对胸膜腔感染的判断优于胸部CT。
在复杂胸腔感染的治疗中,超声对于治疗方式的选择及干预时机的判断具有重要指导价值,具体体现在以下方面:首先,超声是诊断性穿刺的重要辅助工具,可精准定位积液位置,为首次穿刺提供可靠引导。其次,通过超声观察积液的形态特征,能为治疗方案的制定提供关键依据:若超声显示积液呈自由流动状态,提示单纯引流可能实现治愈;若发现积液存在大量分隔或包裹,则表明病情更为复杂,单纯引流往往难以彻底解决问题,此时建议尽早采取强化干预措施,包括胸腔内注射纤溶剂、内科胸腔镜治疗或电视胸腔镜外科手术(VATS)等;而当超声显示已形成纤维板且膈肌固定时,提示病变进入机化期,病情严重,通常需要借助VATS或开胸手术进行治疗。
(2)胸管选择:不同型号(<10号、10~14号、>20号)胸管的临床预后无太大区别,目前主流推荐使用14号以上胸管,无需过粗。较细胸管建议定期用盐水冲洗,防止因脓液黏稠而堵塞。
3. 胸腔内注射纤溶剂和胸腔冲洗治疗
既往常用尿激酶或链激酶等纤溶剂,但MIST1研究显示链激酶对患者预后无改善作用。后续MIST2研究发现,胸腔内注射组织型纤溶酶原激活剂(t-PA)联合脱氧核糖核酸酶(DNase)能显著改善胸腔引流,减少手术需求,缩短住院时间,而单用t-PA或单用DNase治疗均无效,这也提示我们胸腔积液中大量细胞破碎后产生的DNA可能也会增加积液的黏稠度进而导致引流失败。
然而,胸腔内注射纤溶剂联合给药并不适用于所有患者,主要因其存在出血风险,尤其是对于出血患者或正在接受抗凝/抗血小板治疗的患者,此类患者可以考虑胸腔冲洗。研究发现,生理盐水冲洗(如每日3次)可以改善胸腔积液引流,减少胸膜感染手术转诊。但该研究样本小且存在患者选择偏倚,仍需要进行大型多中心随机对照试验来进一步评估其效果。
胸腔内注射抗生素有效吗?由于抗生素无法在胸腔内均匀分布,没有有效的证据,因此不推荐,此种方法仅在特定术后继发胸腔感染的情况下使用。
4. 手术干预
外科手术干预能够松解粘连、清创、闭合胸膜腔、剥脱纤维板、改善引流,是各大指南推荐的治疗方法。小样本研究显示,VATS治疗脓胸的效果优于胸管引流联合/不联合胸腔内注射纤溶剂。与传统开胸手术相比,VATS在手术时间、引流时间、住院时间、疼痛、气胸等方面均更具优势,因此大部分患者已不需要进行开胸手术。2010年英国胸科学会(BTS)胸膜疾病指南和2017年美国胸外科学会(AATS)脓胸管理指南均提倡对脓胸进行积极的VATS干预。
MIST3研究是一项新冠疫情期间在欧洲开展的Ⅲ期试验可行性研究,目的是探讨早期胸腔内注射纤溶剂和早期VATS治疗胸膜腔感染的随机临床试验的可行性。研究共入组60例患者,分为早期IET组(t-PA+DNase)、早期VATS组和标准治疗组,研究过程中根据患者病情变化,允许所有患者进行补救性IET治疗和/或VATS治疗。早期IET组开始干预时间为1 d,早期VATS组为3.5 d(疫情期间手术可及性受到影响)。结果显示:早期IET与早期VATS组中位住院时间为7 d,标准治疗组为10 d。早期IET组EQ-5D效用指数改善更显著,优于早期VATS组;早期IET组2个月疼痛评分最低;早期VATS组1例发生严重不良反应,因术后肝动脉破裂死亡。由此可见,早期胸腔内注射纤溶剂或早期VATS治疗可以缩短住院时间,且早期胸腔内注射纤溶剂患者的远期生活质量更好、疼痛评分更低(需注意MIST2研究中胸腔内给药短期可能引发疼痛)。尽管该研究的实施受到了新冠疫情影响,但研究结果提示,未来可以针对早期IET疗法和早期VATS手术治疗胸膜腔感染进行更大规模的RCT研究。
多项研究显示,内科胸腔镜治疗胸膜腔感染的成功率在79.3%~97.7%之间,差异与患者选择及疾病分期有关。其中有2项研究提及,1期患者内科胸腔镜治疗的成功率最高,2期患者成功率多在90%以上,而3期患者的成功率较低(50%~58%)。2020年Ann Am Thorac Soc杂志发表的一项前瞻性随机对照研究表明,内科胸腔镜与胸腔内注射纤溶剂+DNase治疗的预后无显著差异,但内科胸腔镜可以缩短住院时间,能更迅速地解决临床问题。这也提示我们,在DNase不可及的情况下,内科胸腔镜同样可以作为胸膜腔感染患者的一种有效的治疗选择,且如果治疗及时,内科胸腔镜的成功率非常高,相对于外科手术创伤更小、成本更低,是值得研究和推广的技术。
病例1:男性患者,40+岁,因社区获得性肺炎发热入院,入院时即有剧烈胸痛,但胸腔积液初期较少不宜引流,在强效抗感染情况下仍进展为脓胸,复查胸部CT显示包裹性积液(图1)。
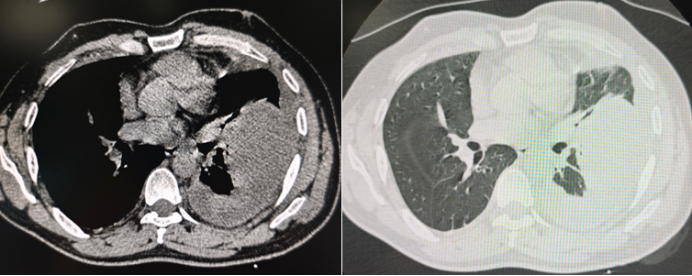
图1 入院后患者胸部CT
从影像学表现来看,实施内科胸腔镜手术的难度并非极大。在胸腔镜下观察,该病例符合胸膜腔感染2期(纤维沉积化脓期)病变特征,胸腔内可见大量包裹性积液及纤维条索形成,尚未形成大量脓苔或纤维板。然而,术中因胸腔内纤维粘连严重,操作视野极差,几乎无法辨别肺组织与胸壁的位置关系,需要持续对粘连进行松解。借助半硬质胸腔镜前端进行钝性分离操作后,患者恢复状况良好,未出现肺容积丧失的情况,胸腔内病变吸收效果十分理想(图2)。
视频1
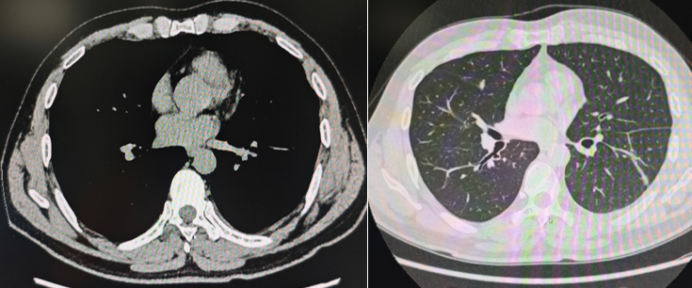
图2 内科胸腔镜治疗后胸部CT
病例2:男性患者,60余岁,因肺炎伴少量胸腔积液入院,NGS检测病原体为口腔普雷沃菌。经询问病史,患者口腔卫生状况极差,且无其他基础疾病。遂予美罗培南抗厌氧菌治疗,治疗后患者体温及炎症指标快速下降。数日后,患者再次出现发热症状。胸片示大量胸腔积液,且已进展为脓胸。随即为患者放置胸管引流,之后患者体温再次下降。过程中给予尿激酶胸腔内注射,后因血尿停用。几天后患者体温再次升高,复查胸片可见右上肺出现包裹性积液(图3)。请CT室医师协助,从肩胛骨内侧另置一根胸管进行引流,然而患者病情仍未得到改善,持续发热,因此决定实施内科胸腔镜下粘连分离术。
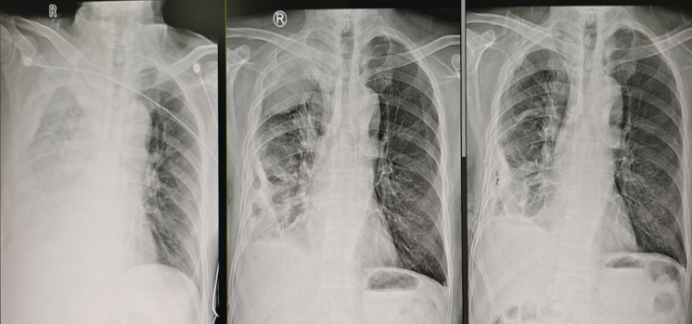
图3 入院后患者胸片变化
该患者胸腔内存在大量粘连带及脓苔,若仅依靠胸腔镜或活检钳进行钝性分离,操作效率极低,难以有效清除脓苔。而在胸腔镜下采用冷冻治疗,效率会显著提高。但该操作存在一定风险,术中需格外谨慎。由于胸膜腔感染的患者胸腔正常结构消失、粘连对于镜下视野干扰较大,红色区域究竟是胸壁还是肺组织,需要仔细辨别。若粘连与肺组织结合极为紧密,切勿强行分离,否则可能撕裂肺组织,引发大出血;此外,还可能导致持续性漏气,使气胸难以愈合。该患者内科胸腔镜术后状态明显改善(图4),未再发热,顺利出院。
视频2
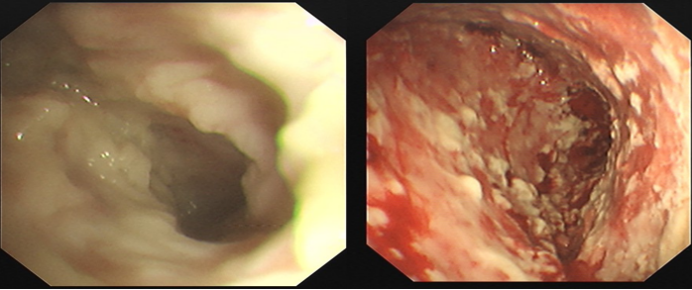
图4 患者内科胸腔镜治疗前后对比
病例3:支气管扩张继发脓胸、脓毒症的患者,脓液多集中于叶间裂区域。经超声检查后,因胸腔内广泛粘连,缺乏适宜的进镜操作空间。基于此,考虑采用边进镜边探查脓腔的策略。进镜后,未发现脓腔,随后借助活检钳沿壁层胸膜进行钝性分离和探查,探及脓腔后扩大脓腔入口,进而进镜对脓腔进行清理(图5)。术后第二天患者脓毒症状态迅速改善,术后1个月随访CT显示治疗效果理想。
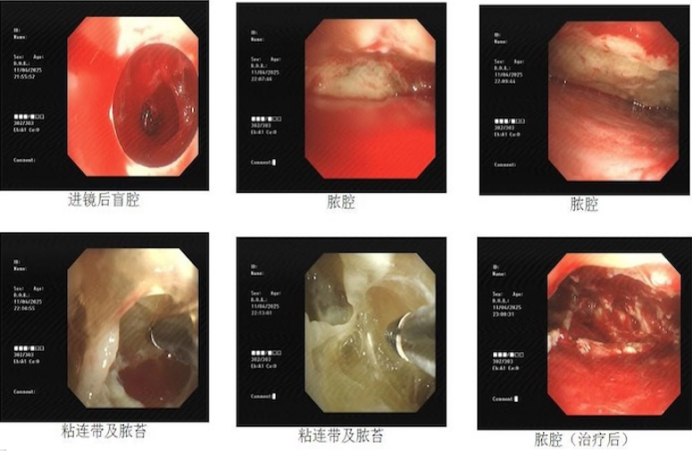
图5 胸腔镜下所见
胸膜腔感染的治疗需根据患者具体情况,结合抗生素、引流、纤溶剂、手术及内科胸腔镜等多种方法,早期诊断和干预对改善患者预后至关重要。
作者介绍

胡展维
北京大学第一医院呼吸和危重症医学科,副主任医师,医学博士;CTS-ACCP认证PCCM专科医师;北京医师协会呼吸内镜和介入专科医师分会总干事,北京医学会呼吸病学分会间质病学组委员,海峡两岸医药卫生交流协会台海医学发展工作委员会呼吸介入和胸部肿瘤学组组员。
 后可发表评论
后可发表评论




友情链接
联系我们
 公众号
公众号
 客服微信
客服微信