登录方式
方式一:
PC端网页:www.rccrc.cn
输入账号密码登录,可将此网址收藏并保存密码方便下次登录
方式二:
手机端网页:www.rccrc.cn
输入账号密码登录,可将此网址添加至手机桌面并保存密码方便下次登录
方式三:
【重症肺言】微信公众号
输入账号密码登录
注:账号具有唯一性,即同一个账号不能在两个地方同时登录。
作者:刘学松
单位:广州医科大学附属第一医院 国家呼吸医学中心 广州呼吸健康研究院 呼吸与危重症医学科

机械通气是利用呼吸机通过不同模式和参数来实现向肺部输送压力或气体以达到呼吸支持的目的。但呼吸机也是一把双刃剑,它在为患者提供呼吸支持的同时,也会导致相关性损伤,例如呼吸机相关性肺损伤(VILI)、呼吸机相关性膈肌功能障碍(VIDD)、呼吸机相关性肺炎(VAP)、呼吸机相关性不适(VAUE)。2004年发表在Critical Care Medicine 杂志的研究显示,在ARDS以外的原因接受机械通气的患者中,多达24%会发生VILI。
VILI有多种类型,包括:高气道压力导致的“压力伤”、大潮气量导致的“容量伤”、肺泡反复开放闭合导致的“剪切伤”、细胞介导的肺部或全身炎症反应导致的“生物伤”、机械能导致的“能量伤”等。
呼吸机参数需要设定什么,如何设定才能保证通气同时还能减少肺损伤,这些都是临床需要关注的问题。呼吸机参数包括潮气量(VT)、吸气压力(Pinsp)、吸入氧浓度(FiO2)、呼吸频率(f)、流速(Flow)、吸呼比(I:E)、呼气时间(Te)、吸气时间(Ti)等。我们还需要通过一些反馈来改善通气支持技术。

1. 呼吸机波形
最常见的呼吸机波形在床边就可以得到,呼吸机波形主要分为两类,一类是“曲线”,包括:流速-时间波形(F-T曲线)、压力-时间波形(P-T曲线)、容量-时间波形(V-T曲线)。另一类是“环”,包括压力-容量环(P-V环)、流速-容量环(F-V环)、压力-流速环(P-F环)。
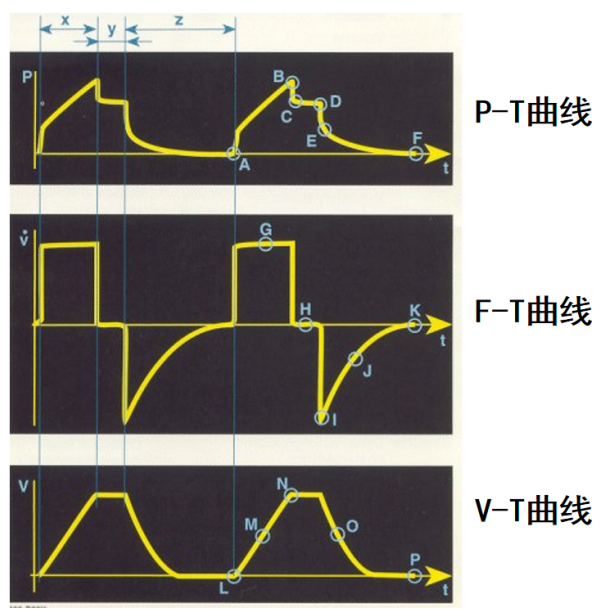
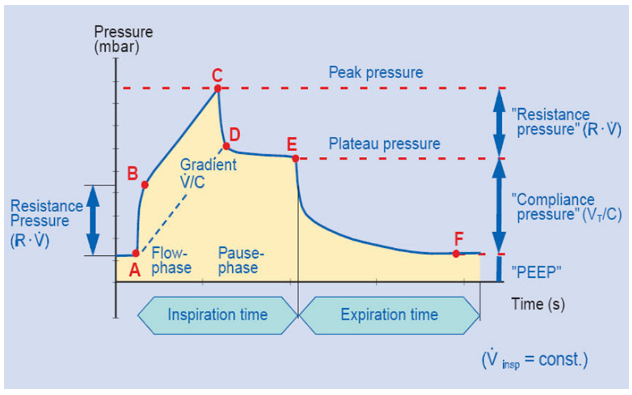
我们可以看到,在经典的压力-时间曲线中,A至B点反映了吸气起始时所需克服通气机和呼吸系统的所有阻力,B点后呈直线状增加至C点,C点代表气道峰压(PIP),是气体流量打开肺泡时的压力,在C点时通气机输送预设潮气量的气道峰。A点至C点的吸气时间(Ti)是有流速期,D点至E点为吸气相内“吸气后屏气”,为无流速期。C点后压力快速下降至D点,其下降速度与从A上升至B点速度相等。C点至D点的压力差主要是由气管插管的内径所决定,内径越小C-D压差越大。D点至E点即平台压是肺泡扩张进行气体交换时的压力,取决于顺应性和潮气量的大小。D-E的压力若轻微下降可能是吸入气体在不同时间常数的肺泡区再分布过程,或整个系统(指通气机和呼吸系统)有泄漏。通过静态平台压测定,即可计算出气道阻力(R)和顺应性(C),PCV时只能计算顺应性而无法计算阻力。
此外,通过P-V环也可以了解肺的顺应性,还可以观察到低位拐点和高位拐点,用来滴定PEEP。F-V环可以观察有无气体陷闭或漏气等情况。
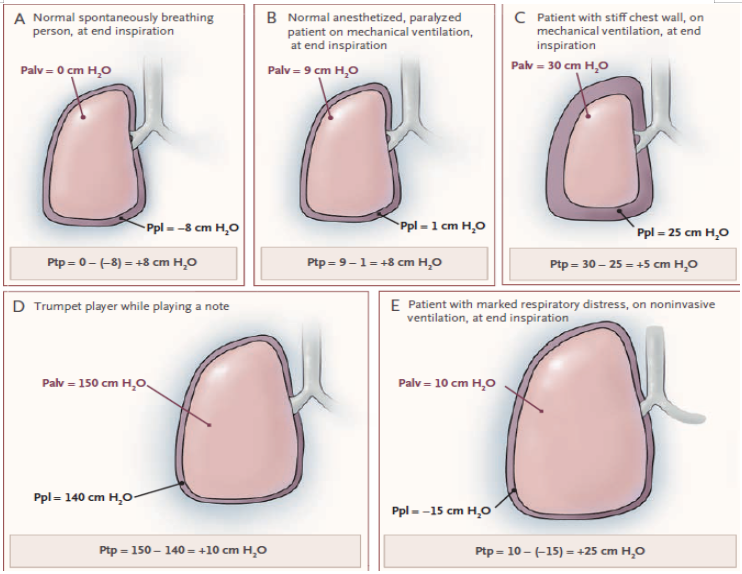
2013年N Engl J Med 杂志发表的文章显示,即使肺泡内压可以达到150 cmH2O,都没有发生肺损伤。原因在于胸内压增高(约140 cmH2O),此时,跨肺压仅有约10 cmH2O,压力相互制衡,肺泡没有过度膨胀!(如下图D所示);相反,如果患者自主呼吸紊乱且很强,胸腔负压很大,可能即使肺泡内压不高时跨肺压也会很大(如下图E所示)。所以重度ARDS时,患者自主呼吸强烈,尽管平台压没有明显升高,但肺跨压明显升高,甚至超过安全限值,则VILI加重。
2. 跨肺压监测
跨肺压是在肺泡表面和胸膜腔之间界面上施加的压差,可理解为肺泡内压与胸膜内压之间的压力差,即:跨肺压=肺泡内压-胸膜腔内压。胸膜腔内压与大气压之间的压力差被称为跨壁压(CWP)。在休息状态下,跨肺压约为4 mmHg,跨壁压约为-4 mmHg,肺的内向弹性回缩力与胸壁的外向弹性回缩力完全相抵消,没有气流流动。
跨肺压=气道压(Paw)-食道压(Pes)。在正常人中,跨肺压随吸气和呼气而变化;增加跨肺压会导致肺容积增加和吸气气流增加(吸气末或呼气末时,气体停止流动,气道压=肺泡内压)。食管导管配有食管球囊可以测量食管压力,临床中通过食道压来反映跨肺压,该压力可以作为胸膜腔内压的替代指标,因其位置接近。跨肺压是肺泡内压减去胸膜腔内压。所以对于机械通气患者,跨肺压相对容易计算。
研究发现,对于无自主呼吸的ARDS患者,在镇静肌松情况下,在呼气末保持跨肺压持续正压;对于有自主呼吸的ARDS患者,食道测压显示自主用力引起食道压负值(约−10 cmH2O),吸气的跨肺压有时可以超过20 cmH2O,因此需要进行加深镇静。所以,使用食道压、跨肺压进行个体化监测,可用于指导有自主呼吸时的通气参数设置,确保安全有效的通气。此外,监测有自主呼吸努力通气患者的跨肺压有助于进行肺和膈肌保护性通气策略,建议吸气末跨肺压≤20 cmH2O,跨肺驱动压≤15 cmH2O,从而避免高吸气努力导致VILI和患者自身造成的肺损伤(P-SILI)的发生。
监测跨肺压,有助于指导呼吸机参数设置,实施肺保护性通气策略。吸气末跨肺压(PtpI)=平台压(Pplat)-吸气末食道压(PesI),决定吸气末肺泡是否过度扩张,指导设定安全的平台压,推荐维持在20 cmH2O以下。呼气末跨肺压(PtpE)=PEEP总(PEEPtot)-呼气末食道压(PesE),决定呼气末肺泡是否塌陷,指导PEEP滴定,临床推荐维持在0 cmH2O以上。跨肺驱动压(ΔPtp)=吸气末跨肺压(Pplat–PesI)-呼气末跨肺压(PEEPtot–PesE),决定呼吸时使肺发生形变的驱动力,指导设置潮气量,临床推荐维持在10~12 cmH2O以下。
正常人的肺各部分压力不同,平卧状态下腹侧和背侧的压力也不同。跨肺压在肺垂直梯度上呈非均匀分布。在低PEEP水平下,跨肺压在重力依赖肺区较高,反复出现气道开放和陷闭,其中部分区域可能会受到反复复张的影响。在高PEEP水平下,非重力依赖肺区的跨肺压较高,可能反映局部过度扩张的情况。
3. 肺电阻抗成像(EIT)
EIT的原理是以人体内部的生物电阻率分布为目标重建体内组织图像。胸部EIT成像已排除了心脏、血流等电阻抗的影响,仅反映肺局部通气情况。
EIT能够反映局部和整体肺组织的气体分布变化,可以用于监测局部肺组织的塌陷、复张以及过度膨胀。相对于传统的ARDSnet表格法,EIT法(气体分布导向的PEEP滴定方法)可以通过监测肺内通气引起的胸内阻抗变化反映局部肺组织的呼吸力学变化。相较于CT法,EIT法具有无创、无辐射和床旁实时监测等优点。
ARDS患者靠近腹侧的通气量较大,靠近背侧的通气量较小。因此我们要考虑如何改善患者背侧的通气量。EIT有助于ARDS患者的管理,可监测患者对俯卧位的反应,确定HFNC的流量。此外,EIT还可用于指导PEEP滴定。笔者所在中心开展了一项EIT用于慢阻肺ARDS患者PEEP滴定的研究,研究显示,在合并慢阻肺的ARDS患者中,EIT滴定的PEEP水平低于ARDSnet方案滴定的水平,这有助于改善通气比、机械能、心脏指数和氧气输送,且对血流动力学的不良影响较小。ARDS患者的肺有膨胀也有塌陷,研究发现,COVID-19患者肺复张性差异很大。EIT能够指导个性化的PEEP设置,作为复张性和过度膨胀之间的折衷方案。目前已有研究EIT用于指导ARDS患者和慢阻肺患者通气时PEEP的选择,但对于合并慢阻肺的ARDS患者的PEEP选择的研究仍然极少。
此外,EIT还可用于评估肺灌注。肺灌注评估是利用肺血流脉动引起的阻抗变化来反映肺血流流动情况,可以提供区域肺灌注和通气/灌注(V/Q)比例图像。但目前临床证据比较少,尚未得到较好的验证。
4. 肺部和膈肌超声
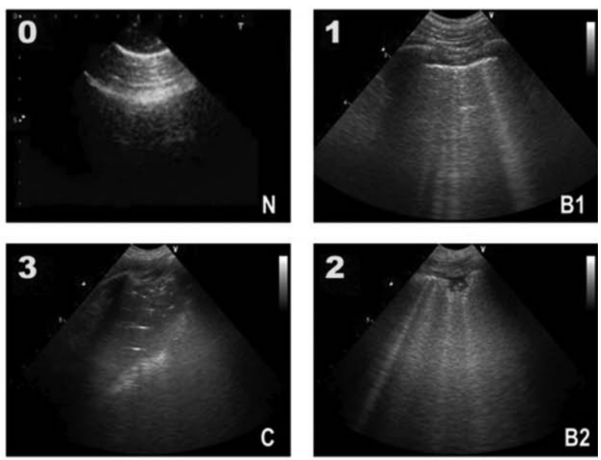
肺部超声的临床应用逐渐增多,且日益受到重视。如下图所示,N(正常):A线/2条及以下B线;B1:B线间隔大于7 mm;B2:B线间隔小于3 mm;C:碎片征,动态支气管充气征。每个区域取最差征象。利用mBLUE方案进行肺部超声的分区,评估肺复张情况。根据LUS评分滴定PEEP,PEEP滴定根据部分区域胸膜滑动征消失进行选择。
动物研究以及临床研究均发现,即使采取了肺保护性通气,也可能导致肌纤维萎缩、力量下降,在肺保护性通气过程中也可能损伤膈肌。膈肌是最重要的呼吸肌,临床上机械通气、慢性心肺疾病、药物、心胸手术、脓毒性休克、慢性营养不良等多种原因均可引起膈肌功能障碍,从而导致患者脱机困难、ICU住院时间延长等。由于超声具有准确、安全、无创等优点,能够很好地评估膈肌结构和功能。
膈肌位移的定位点与测量方法:患者平卧位,使用3.5~5 MHz凸阵超声探头,从患者机械通气第1天开始测量,连续5天分别测量患者前部、中部、后部膈肌位移。膈肌位移(mm)=呼气末膈肌距离(mm)与吸气末膈肌距离(mm)的差值。膈肌增厚率(%)=[吸气末膈肌厚度(mm)-呼气末膈肌厚度(mm)]/呼气末膈肌厚度(mm)×100%。
前部和中部膈肌位移测量方法:前部和中部膈肌位移定位点位于腋中线与第10肋缘处(下图A),将超声探头置于此,探头标记点朝向患者右侧,寻找肝脏边缘最强回声,调整超声探头方向确定膈肌位移最大位置,选用解剖M型超声,并将取样线分别垂直定位于膈肌全长的上1/3处即为前部测量点,垂直于膈肌全长的后2/3中间段即为中部测量点,记录随呼吸运动的前部和中部膈肌位移(下图B)。
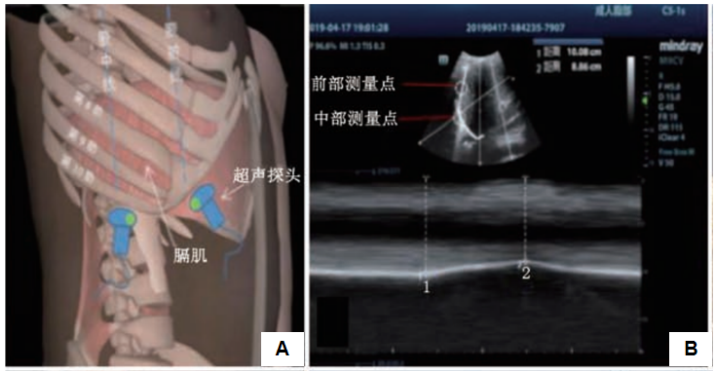
后部膈肌位移测量方法:后部膈肌位移定位点位于腋前线与肋弓边缘处(下图A),将超声探头置于此,超声探头朝向头部,探头标记点朝向患者右侧,调整超声探头使其处于膈肌位移最大位置,用M型超声记录随呼吸运动的后部膈肌位移(下图B)。

膈肌厚度的定位点及测量方法:前部膈肌厚度定位点位于锁骨中线与第8~10肋间隙交界处,中部膈肌厚度定位点位于腋中线与第8~10肋间隙交界处,后部膈肌厚度定位点位于腋后线与第8~10肋间隙交界处(下图A)。患者取平卧位,使用10~13 MHz线阵超声探头,分别置于前、中、后部膈肌厚度定位点,用M型超声分别记录吸气末和呼气末的膈肌厚度(下图B)。
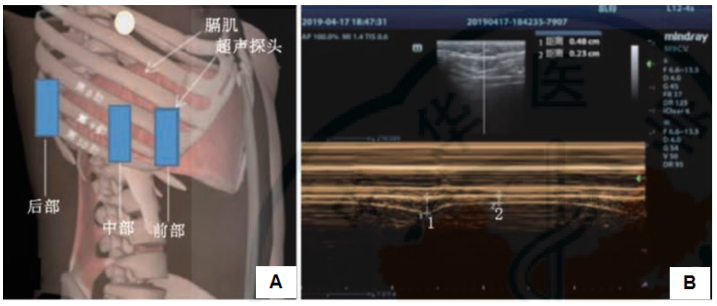
研究显示,膈肌超声可作为机械通气脱机成功的有效预测。测量膈肌偏移和膈肌增厚分数可以预测脱机成功率,低膈肌偏移值和膈肌增厚分数可以预测中到高特异性拔管失败的风险,膈肌功能障碍与拔管失败的风险增加有关。此外,膈肌超声还能指导PEEP的设定。

即使在正常情况下,肺也具有不均一性,发生ARDS时,这种不均一性会更加明显,因此机械通气会更加复杂,既有通气相对正常区域,也有肺泡塌陷区域,还有肺组织周期性扩张和陷闭区域(肺萎陷伤)区域,以及肺过度充气区域(肺容积伤)。这些区域混合叠加,更容易导致肺损伤。在我们认为肺部情况似乎尚可的区域,PET/CT仍然发现有肺损伤,所以我们需要结合呼吸力学、气体交换、临床表现等各方面进行个体化的通气滴定。
临床中我们要关注呼吸机波形的四要素——容量、流速、压力、时间,综合解读。跨肺压监测有助于肺膈保护性通气策略的实施;EIT可用于肺部气体分布的判断,ARDS肺复张,指导PEEP滴定;肺部超声可以判断肺复张,预测机械通气撤机成功率及指导机械通气参数设置。需要注意的是,肺损伤无处不在,肺保护一刻不能忽略,结合患者的病理生理改变,通过多维度的呼吸力学、跨肺压、EIT、超声等床旁监测技术指导临床进行个体化机械通策略,才能更好地保护受伤的肺。
参考文献
作者介绍

本文仅用于学术内容的探讨和交流,不用于任何商业和推广。临床实践需根据患者的具体情况选择适宜的处理措施。
 后可发表评论
后可发表评论




友情链接
联系我们
 公众号
公众号
 客服微信
客服微信