作者:曹君
中心气道狭窄是指由多种病因引起的气管、左右主支气管及右中间段支气管的气道狭窄。导致中心气道狭窄的原因包括良性和恶性,无论是良性还是恶性疾病引起的中心气道狭窄均可导致不同程度的呼吸困难、喘鸣和阻塞性肺炎等,有部分患者可能因此出现窒息而危及生命。根据狭窄的严重程度可将中心气道狭窄分为1~5级,≥3级(狭窄程度≥50%)即为重度中心气道狭窄,可导致严重呼吸困难或窒息死亡。中心气道狭窄的严重程度分级见表1。
值得注意的是,气道狭窄程度有时与症状不一定成正比,我们认为管腔内直径<正常值的50%表示“重度的气道阻塞”。使用固定的任意截止线来确定症状是否可归因中心气道狭窄是有问题的,因为除了简单的管腔内直径之外,还必须考虑其他因素,例如基础心肺功能、痰液引流情况等。一般而言,与气管狭窄相关的运动症状直到管腔内径<8 mm,在管腔内径<5 mm之前不会出现静息症状。良性和恶性中心气道狭窄的主要通过管径和横断面积占比进行评估。
- 恶性中心气道狭窄:管腔的狭窄程度=最窄的管径/正常的管径×100%
- 良性中心气道狭窄:狭窄横断面积占正常气管横断面积的比例
(1)通过CT等检查已明确重度中心气道狭窄,尤其是气管狭窄,狭窄程度越高,急诊处理指征越强。
(2)症状体查评估:呼吸急促、不能平卧、喘鸣、大汗淋漓、三凹征、单侧呼吸音减弱或消失、双侧呼吸音减低等提示致死性呼吸困难可能,需急诊干预。
(3)如果既往肺功能正常的患者,即使动脉血二氧化碳分压(PaCO2)轻度升高,也应引起高度重视,按急症紧急处理。
(4)还需要综合考虑其他因素,如排痰能力、基础肺功能等情况。
中心气道狭窄的病因有多种,导致恶性中心气道狭窄的病因主要为恶性肿瘤,良性中心气道狭窄的病因分为先天性和获得性,详见图1。
中心气道狭窄的治疗类技术主要是包括传统的外科手术和呼吸介入技术。传统手术创伤大,风险高。对于良性气道狭窄,术后存在吻合口瘢痕形成导致再狭窄可能。呼吸介入技术在良/恶性气道狭窄的治疗中发挥了非常重要的作用,包括热消融、冷冻、机械扩张、气道内近距离放射治疗、光动力治疗等技术(图2)。(1)慢起效消融技术:包括微波和冷冻(冻融),不适合气管重度腔内肿瘤开放气道治疗,因其可导致水肿,加重气道梗阻。冻融可以在吸高浓度氧时操作,简单、安全,不损伤支架,花费低,亦可用于装有起搏器的患者。(2)快起效消融技术:适合于较大的病变。主要包括:①激光:效率高(肿瘤切除金标准),设备贵、操作风险较大;②高频电:圈套器(效率高)适合于基底较窄的肿瘤,快捷安全,性价比高,吸氧低于40%;电刀、热活检钳、相对安全;③氩气刀(APC):止血效应安全高效,切除效率低;④冻切:效率高,操作风险较大(出血),凝血功能差,不宜选择。临床中需要根据患者的具体情况、手术特性和医生对操作技术的熟练度选择合适的热消融技术(表2)。气道支架包括硅酮支架、金属支架(覆膜支架,裸支架)。需要注意的是,硅酮支架贴壁性较差,不适合扭曲气道、不适用于锥形狭窄;重度外压型气道狭窄是气道支架治疗的绝对适应证;重度混合型狭窄适于覆膜支架置入治疗;良性气道狭窄严禁放置永久性金属支架。临床中需要参考CT或支气管镜检查选择合适的支架直径和长度,避免出现支架不稳、脱落或移位等情况。常用气管支架直径/长度为18、16 mm/40、60mm,左主支气管支架直径/长度为10、12 mm/30、40 mm,右主支气管支架直径/长度为12、14 mm/30、40 mm。笔者科室多选择软镜置入金属支架,在局麻及静脉镇静镇痛下(咪唑安定+芬太尼/舒芬太尼)能够顺利完成。大多数严重呼吸困难端坐呼吸的患者使用静脉镇静镇痛后均能平卧。
在支架置入过程中最重要的是保证氧合,下列是操作过程中保证氧合的一些措施:①置入支架前使用激素预处理(如无禁忌);②常规氧疗/高流量氧疗,高频通气备用;③治疗过程中也可以间歇使用呼吸球囊辅助;④必要时预置供氧管(导丝引导,通常选择吸痰管或氧气管供氧);⑤必要时可在无创/有创通气支持下进行支架置入。
重症气道狭窄急诊开放气道的指征:①严重气管阻塞或隆突、双侧支气管阻塞;②一侧肺切除或功能丧失,另一侧阻塞,短期内危及生命者;③呼吸困难明显及综合其他情况。笔者科室的经验:个体化治疗策略与狭窄严重程度及部位等有关。对于致死性气道狭窄——主气管及隆突部位狭窄程度大于75%或左主、右主支气管同时重度狭窄,需要紧急开放气道!无论何种气管狭窄,紧急情况或消融技术受限可直接进行支架置入治疗,迅速开放气道。(1)大方向把控:重症气道梗阻先解决梗阻,满足功能需要,而不是结构正常。(2)根据中心现有条件和技术水平,采用熟悉的技术,力求实用、有效、简便、安全、经济(费用)。(3)细节把控:术前讨论、术中各种应急预案(备4.0~7.5各型气管导管、加长气管导管等特殊导管、气切包等)、术中麻醉深度维持/控制及生命体征监测等。
(4)并发症处理:大出血、气胸、支气管痉挛等的处理。
良性中心气道狭窄分为结构性和动力性(6种类型),结构性狭窄包括:管腔内生长(1型),外源性压迫(2型),瘢痕孪缩(3型),扭曲变形(4型);动力性狭窄包括:气道膜部向内膨出(5型),气道软化(6型)。对于动力性狭窄,应考虑用力呼气时的状态,通过操作者的判断,定出最合适、最接近的狭窄程度。治疗方法的制定不仅与气道狭窄程度和长度有关,还与是否存在狭窄过渡段有关。狭窄长度的计算应包括过渡区域。良性气道狭窄形态学分类的诊断方法应通过支气管镜所见及放射学检查来确定。每一个狭窄都可以用4个数字来表示,分别代表部位、类型、狭窄程度、狭窄长度。如:1344代表声门下瘢痕性挛缩性狭窄、狭窄程度>75%、狭窄长度>5 cm,这是一种非常难以处理的良性气道狭窄;2311代表气管瘢痕性蹼状网眼狭窄、狭窄程度<25%、狭窄长度<1 cm,这是一种比较容易处理的良性气道狭窄。热消融技术(APC、电凝、激光)是治疗增生性气道腔内病变(如良性肿瘤和单纯肉芽)的简单、快速的方法。但在治疗瘢痕狭窄病变时,其本身可对气道造成更重、更大范围的损伤,引起更为严重的肉芽组织增生和瘢痕形成,从而导致复发率高,且治疗次数的增加可导致狭窄病变范围增大并最终破坏软骨,导致气道塌陷,使患者彻底失去治愈的机会。电凝和APC仅适合管腔内生长的1型良性中心气道狭窄,并不适合其他类型良性中心气道狭窄的治疗。即便如此,基底部的处理也应避免使用此类治疗方法。针形电刀与气道黏膜接触面极小,不会造成损伤面扩大,瘢痕性气道狭窄的治疗宜选用针形电刀进行切割、松解。因激光也有切割的作用,因此也可选用激光治疗,钬激光、铥激光控制烧灼深度最浅可达0.4 mm,因此更适合良性瘢痕增生性气道狭窄的治疗。冷冻治疗分为冷冻切除(简称冻切,cryoextraction)及冷冻消融(简称冻融,cryoablation)。对于腔内生长的病变可采用冻切治疗,由于容易出血,其安全性不如热消融技术。对于瘢痕病变,冻切技术无法实施,则采用冻融治疗,冻融治疗不促进肉芽组织增生。与热消融相比,冷冻不易导致软骨损伤。通常在热消融治疗接近气道壁时或球囊扩张后采用冻融治疗处理剩余病变,有利于减轻瘢痕再狭窄发生的速度与程度。严重气道狭窄在开通气道前不要使用冻融,因其可引起气道水肿,加重气道狭窄,从而导致窒息。因此,冻融治疗后肺部体征监测及气管镜复查十分重要。机械扩张技术包括球囊扩张和硬质支气管镜扩张,并发症有气道撕裂、再狭窄、出血。(1)球囊扩张:是治疗瘢痕性气道狭窄最主要的技术,其优势是患者治疗后无明显的狭窄段延长,狭窄复发时再狭窄的程度比热消融治疗后轻得多,有利于维持气道复张的疗效。对气管黏膜损伤小,可以在软镜下应用,但需要中断通气。对于挛缩、韧性较强的瘢痕,可先用针形电刀进行切割以松解瘢痕;避免直接暴力球囊扩张,导致气道膜部的撕裂伤。(2)硬质支气管镜扩张:其优势是扩张时不需要中断通气,安全性更好。针对瘢痕肉芽组织增生导致介入治疗后的气道再狭窄,可采用气道狭窄部位局部应用药物的方法抑制瘢痕肉芽组织增生。介入治疗后气道再狭窄可选择的治疗药物有:糖皮质激素、丝裂霉素C、曲尼斯特、紫杉醇等。通过直接植入放射性物质(最常用铱-192)或经过可弯曲支气管镜近距离照射气道瘢痕肉芽组织,促使成纤维细胞凋亡。气道支架置入首选硅酮支架,禁用金属裸支架。支架治疗应作为良性气道狭窄最后选择的治疗技术,启动气道支架治疗的指征:①应用前述各种治疗方法疗效不佳,不能维持气道通畅;②在确定外科手术前临时放置;③外压性气道狭窄;④气道软化、塌陷且无法或不准备行外科手术治疗。病例1:17岁,女性,骨折术后肺炎插管,拔管后(2月14日)气道明显狭窄(图3)。2月15日评估:HR 113次/min,R 24次/min,静息下SpO2 97%(FiO2 50%),咳嗽及说话后喘鸣,有阵发性血氧下降。会诊后拟行急诊介入治疗。2月15日无痛气管镜示:声门下腔黄色及乳白色膜状坏死物,气管上段大量黄色坏死物并管腔重度阻塞,仅见小孔,以冷冻法清除坏死物后管腔通畅(图4)。术后气促明显改善,无需吸氧。病例2:77岁,女性,呼吸困难2个月,加重3天,于2023年12月2日入院(2023年9月气管插管,插管后20余天后拔管)。入院当天查体:HR 125次/min,R 30次/min,静息下SpO2 96%(高流量FiO2 30%),PaCO2 56 mmHg。患者术前影像如图5所示。12月3日查体:HR 140次/min,R 35次/min,BP 190/90 mmHg,SpO2 68%~75%(FiO2 100%),躁动不安,急查血气分析:PaCO2 89 mmHg。紧急床旁无创通气支持下气管镜:气管上段狭窄80%以上,较多黄白黏稠分泌物在狭窄口随呼吸摆动,予抽吸后SpO2升至98%,见狭窄处直径约3 mm,外径5.2 mm,软镜无法进入,遂置入导丝,10#球囊扩张多次,狭窄部位增宽,外径4 mm气管镜引导6.0号气管导管经口插管成功(图6)。插管后患者HR 98次/min,复查血气分析示PaCO2 41 mmHg,氧合指数300 mmHg以上。12月4日气管镜示:右鼻旁路进镜,缓慢退气管导管至声门,距声门3 cm处狭窄,直径7 mm,予12#球囊扩张1 min,2次,未见出血,扩张后直径约12 mm,地塞米松局部保留,气管导管复位(图7)。12月5日拔除气管导管。12月6日气管镜示:气管上段瘢痕狭窄(管径10~12 mm),少许膜状坏死、未见肉芽,予以清除坏死物,7点、11点冻融,术毕注入地塞米松5 mg(图8)。12月13日气管镜示:气管上段瘢痕狭窄(管径12 mm左右),少许膜状坏死、未见肉芽,予以清除坏死物,7点、11点冻融,术毕注入地塞米松5 mg(图9)。
图9 气管镜下操作(2023-12-13)
12月8日复查胸部CT,气管管径较前明显增宽(图10)。患者于12月14日出院,于当地定期复查。病例3:80岁,男性,发现颈部肿块5年,咳嗽气促1个月入院(2024年1月6日)。2019年1月14日曾于外院置入气管硅酮支架。术前(1月6日):HR 95次/min,R 22次/min,静息下SpO2 97%(FiO2 29%),活动后喘鸣。1月8日硬镜示:气管上段膜部肉芽样新生物致管腔混合性重度狭窄(外压为主),冷冻+直钳清除气管上段膜部新生物(质韧,活检困难),术后直钳上调硅酮支架至气管起始部,完全覆盖狭窄处(图11),术后气促明显改善。术后病理:鳞状上皮化生,伴轻度非典型增生。1月12日凌晨1:09突发气促加重,喘鸣明显,HR 140次/min,BP 200/102 mmHg,R 35次/min,SpO2 97%(FiO2 35%)。紧急联系介入和麻醉团队进行急诊介入治疗,无痛喉罩下正压通气,患者喘鸣消失。支气管镜示:声门下腔水肿,气管起始部见大块坏死物堵塞管腔,随呼吸呈活瓣样,管腔明显狭窄,予冷冻+钳夹清理,支架未移位(图12)。
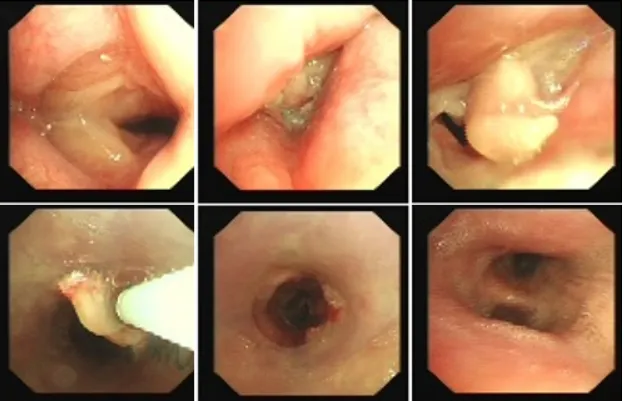
1月12日复查CT:支架位置良好(图13)。予无创通气与高流量交替,拟T管置入。1月14日患者夜间出现刺激性咳嗽,1月15日复查气管镜(软镜)示:声门下腔水肿并坏死物致管腔中度狭窄(图14),冷冻清理坏死物后见硅酮支架下移10 mm,支架第二次移位;声门及声门下腔注入地塞米松5 mg。硅酮支架难题就是肉芽增生和移位,与家属充分沟通后同意T管置入。1月17日全麻硬镜:声门下腔及气管起始部黏膜水肿并坏死物致管腔轻度狭窄,取出硅酮支架,置入T管(图15)。1月19日和20日两次复查气管镜:T管在位,管腔上缘少许坏死物(图16)。病例4:85岁,女性,反复气促2年,外院住院考虑气管外压性狭窄,支架置入失败,心跳骤停,困难插管后3月7日转入我科。入科:气管插管,HR 96次/min,BP 107/86 mmHg,R 24次/min,SpO2 98%(FiO2 100%)。腹膨隆明显。急查胸腹CT示腹腔、纵隔、胸壁及颈部多发积气(图17)。予腹腔穿刺排气。3月11日复查CT示积气明显减少(图18)。3月12日行全院大会诊,考虑结节性甲状腺肿可能,可考虑外科手术。下一步治疗面临难题:继续插管?还是支架置入后手术?与家属充分沟通后,家属拒绝再次支架置入,故继续插管并于3月15日于耳鼻喉科行甲状腺全切术+气管悬吊重建术。术后第3天(3月18日)拔除气管导管,3月28日顺利出院(图19)。因此,并非所有良性气道狭窄都需要介入治疗,解除原发病因最重要。
图19 3月7日和3月28日胸部CT对比
恶性中心气道狭窄分为腔内型、腔外型、管壁型和混合型, 不同类型选择的治疗策略也不一样, 主要治疗手段包括肿瘤消减、机械清除和支架置入(图20)。光动力及近距离放射治疗作用慢, 操作相对复杂, 不适合重症气道狭窄的治疗。(1)腔内型及管壁型:首选肿瘤切除,包括热消融(激光、高频电、氩气刀等)、硬镜机械铲除、冻切、冻融。肿瘤切除后,必要时置入支架(覆膜金属支架/硅酮支架、粒子支架)。(2)腔外型: 重度狭窄是支架治疗的绝对适应证(金属裸支架为首选, 覆膜支架, 硅酮支架)。(3)混合型:肿瘤切除,必要时置入支架(覆膜金属支架/硅酮支架、粒子支架)。病例1:60岁,女性,呼吸困难1年,加重3天,于2011年10月26日入院。术前气道腔内有新生物(图21)。第一次内镜下手术切除部分肿瘤后气管插管;第2天再次手术切除肿瘤,术后顺利拔除气管导管(图22)。术后病理提示腺样囊性癌。术后放疗。术后出现瘢痕部位狭窄,予球囊扩张+冷冻(图23)。目前患者长期生存。
图22 患者手术过程
图23 瘢痕处理
病例2:33岁,男性,全身多处淋巴结肿大1年,气促12天入院(2024年2月22日)。术前(2月22日):被动体位(前倾坐位,不能平卧),HR 136次/min,R 36次/min,SpO2 90%(FiO2 60%)。术前影像学如图24所示。紧急行气管镜检查:气管下段重度外压性狭窄,仅见缝隙,不能窥见隆突,软镜直视下置入金属覆膜支架(MTN-18/50)(图25),支架远端近隆突,术后气促明显改善。术后第4天(2月26日)咽部异物感明显,气促加重,复查胸片支架移位。再次行气管镜示:声门下腔见金属支架,经口取出支架,置入部分覆膜支架(18/40)(图26),支架远端近隆突,术后气促明显改善。B超引导下肿大淋巴结多点穿刺提示为弥漫大B淋巴瘤,后续行淋巴瘤相关治疗。病例3:64岁,女性,咳嗽、咯血、气促1个月入院(2021年12月11日)。气促明显但能平卧,HR 91次/min,R 24次/min,SpO2 94%(吸氧4 L/min)诊断未明确。外院转入。支气管镜检查:左、右主支气管内见新生物,左主混合性闭塞;右主狭窄,右中间段开口见缝隙(图27)。无外科手术指征,采取介入治疗。软镜局麻静脉镇静镇痛(咪唑安定+舒芬太尼),高频通气备用,术前使用甲基强的松龙40 mg静推,治疗策略为分步走,先处理左主,保证氧合:①左主置入导丝以备紧急情况下能快速置入支架;采用生理盐水加压注射法,支气管镜强行进入置入导丝;②充分冲洗清理左肺大量黏稠血性分泌物,防止分泌物溢出导致窒息。处理后患者氧合改善。再处理右主:①探查右中间段(缝隙),生理盐水加压注射法,支气管镜进入右中间段支气管,充分冲洗治疗;②右主支气管冻切活检(少量出血)明确诊断。下一步处理:首选Y型覆膜支架或双侧支气管支架置入,因患者诊断未明确、经济原因及考虑肿瘤的后续有效治疗,放弃Y型支架;左主混合性狭窄,仅在左主置入金属裸支架,右主新生物内镜下切除(冻切+APC)(图28)。2天后复查支气管镜, 左主支架膨胀良好, 右主及右中间支气管予以冷冻冻切残余新生物及消融后焦痂, 治疗后管腔较前进一步通畅(图29)。病例4:52岁,男性,重度呼吸困难,急诊2021年12月20日入院。气管镜检查:隆突浸润明显增宽(鳞癌),左/右主支气管重度外压性狭窄,左侧更明显(仅见缝隙)。第一步,先探查狭窄最重的左主,生理盐水加压注射进入左主,仅左主起始部重度狭窄,清理分泌物,同时置入导丝备用。第二步,探查右主,右上叶支气管基本正常,右主重度外压狭窄并右中间段开口呈缝隙,在生理盐水加压注射下支气管进入右中间段(仅右中间段起始部重度狭窄),冲洗出大量血性黏稠分泌物,置入导丝(图30)。首选Y型金属支架置入,如果没有Y型支架或缺乏置入Y型支架的技术能力,可以分别在左、右置入直筒支架。第三步:置入Y型覆膜支架(图31),使用刘志光改良的Y型支架置入装置(专利),软镜置入快捷(耗时10 min)。支架规格:18/40-14/30-14/20(右)。置入后,支架膨胀良好,呼吸困难显著改善。
图31 置入Y型覆膜支架
无论是良性还是恶性重症气道狭窄,迅速开放气道为第一目的。早期识别重症气道狭窄,要关注气道的狭窄程度、基础心肺功能及排痰能力等并进行综合评估。无论何种气道狭窄,解决原发病是最重要的,原发病无法解除或治疗时,介入治疗能给患者带来获益。个体化评估、选择合适的介入技术、多种技术联合、麻醉深度监测及定期复查维护均十分重要。气道狭窄治疗需要多学科讨论及全程规范管理。硬镜铲切联合PTS、冷冻球囊、药物洗脱支架等的研发也会为重症气道狭窄带来新的治疗手段。[1] 张杰. 良性中心气道狭窄经支气管镜介入诊治专家共识[J]. 中华结核和呼吸杂志, 2017, 40(6):408-418.[2] 金发光. 恶性中心气道狭窄经支气管镜介入诊疗专家共识[J]. 中华肺部疾病杂志(电子版), 2017, 10(6):647-654.[3] Freitag, L, Ernst, A, Unger, M, et al. A proposed classification system of central airway stenosis[J]. EUR RESPIR J. 2007, 30(1):7-12. [4] 李欣雨, 代冰. 中心气道狭窄的呼吸介入治疗策略[J]. 中国实用内科杂志, 2022, 42(9): 717-721.
湖南省人民医院呼吸与危重症医学科,副主任医师,博士研究生。主攻方向:呼吸危重症,感染。抗击新冠肺炎省级医疗救治组组长(衡阳),中国医师协会呼吸医师分会危重症医学工作委员会青年委员,湖南省健康管理学会呼吸重症管理专业委员会副主任委员,湖南省医师协会第二届呼吸医师分会青年委员会委员,湖南省防痨协会临床专业委员会委员,湖南省医学会呼吸专业委员会慢阻肺联盟委员,湖南省哮喘联盟委员,湖南省中医药和中西医结合学会重症医学专业委员会呼吸学组委员兼秘书,湖南省健康服务业协会第一届肺健康分会理事。
 后可发表评论
后可发表评论




 公众号
公众号
 客服微信
客服微信