单位:1. 南京医科大学金陵临床医学院呼吸与危重症医学科;2. 南京医科大学鼓楼临床医学院呼吸与危重症医学科本文来源:中国呼吸与危重监护杂志2024年第23卷第1期
慢性阻塞性肺疾病(简称慢阻肺)是一种以气流受限等慢性呼吸道症状为特征的异质性肺部状况,发病率逐年升高。预计到2030年,慢阻肺将成为全球第三大死因。慢阻肺急性加重是慢阻肺患者的首要死亡原因。近年来,越来越多的研究发现真菌定植、致敏和感染与慢阻肺的急性加重有关。曲霉是其中最受关注的真菌。曲霉普遍存在于自然环境中,产生直径2~3 μm的分生孢子漂浮在空气中,被机体吸入气道后可直达小气道和肺泡。在健康宿主中,曲霉孢子可被免疫防御系统迅速清除或杀灭,而在免疫功能紊乱或存在肺部基础疾病的患者中,曲霉可以导致不同类型的肺曲霉病,包括侵袭性肺曲霉病(IPA)、慢性肺曲霉病(CPA)、变态反应性支气管肺曲霉病(ABPA)、曲霉致敏和曲霉定植等。本综述重点讲述其临床研究进展。
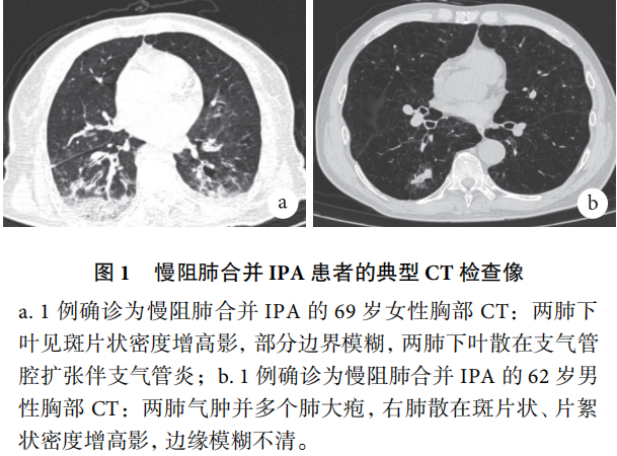
IPA主要由烟曲霉引起,早期临床研究主要关注发生在严重免疫缺陷和粒细胞缺乏(简称粒缺)患者发生IPA的临床诊治。近年来,临床医生发现越来越多的IPA在非粒缺、轻中度免疫缺陷患者中被诊断出来,而慢阻肺是其中最常见的一种基础疾病。因急性加重住进普通病房或重症监护室(ICU)的慢阻肺患者,被认为是IPA的风险人群之一。研究发现在下呼吸道样本曲霉阳性的慢阻肺患者中,有22.2%~80%的患者发展为IPA。慢阻肺合并IPA的患者以气道侵袭性更为多见。慢阻肺患者黏液纤毛清除功能障碍,宿主防御能力减弱,有利于曲霉的定植和感染。长期全身性糖皮质激素的使用抑制单核细胞向巨噬细胞的成熟以及向炎症部位的趋化。此外,糖皮质激素的使用还可降低肺泡巨噬细胞的活性,抑制中性粒细胞的聚集和Th1细胞因子的产生,并增强Th2细胞因子,降低宿主对曲霉的免疫反应,近3个月使用糖皮质激素超过265 mg将增加罹患IPA的风险。笔者团队研究显示,正五聚蛋白3(PTX3)是一种急性时相蛋白,在烟曲霉分生孢子感染时,PTX3转录因子CCAAT/增强子结合蛋白δ上调,促进PTX3的表达和巨噬细胞的吞噬能力,吞噬、清除曲霉孢子。烟曲霉对低氧环境有一定的适应性,且其感染能力因感染部位的不同而改变。在严重缺氧时,烟曲霉可侵袭性生长并侵入肺组织。此外,抗菌药物的使用、既往长期吸烟等也增加了罹患IPA的风险。慢阻肺合并IPA的患者常以咳嗽、咳痰、呼吸困难为最常见且突出的临床症状。肺部新发浸润影、结节影或实变影为常见的放射学征象,而空气新月征和晕轮征较少出现。这些非特异性表现易被误认为是由细菌感染引起的慢阻肺急性加重而漏诊,延误抗曲霉治疗,导致病死率增加。Chen等指出连续两次胸部高分辨计算机断层扫描(CT)动态观察更有助于发现IPA。因为第一次胸部CT往往仅显示非特异性改变,而前后CT对比可显示出动态变化,比如空洞形成等有价值的征象。慢阻肺合并IPA患者的典型影像表现见图1。Bulpa等更新了慢阻肺合并IPA的诊断标准,将诊断级别分为确诊、临床诊断和拟诊。“确诊标准”包括临床表现和3个月内新出现的符合IPA的影像学特征,相应的微生物学证据和组织病理学证据。“临床诊断”包括临床和影像学表现以及微生物学证据。“拟诊”仅具有临床表现和影像学特征。目前大部分患者需要依靠实验室检查来确定肺曲霉病的诊断,达到临床诊断和确诊这两种高级别诊断。曲霉病原检测的方法包括培养、镜检、血清学、组织病理学和核酸检测等。半乳甘露聚糖(GM)抗原检测是临床实践中常用的诊断方法。血清GM试验常被用于IPA的诊断,但在非粒缺患者中敏感性低。Zhou等对非粒缺IPA患者血清和支气管肺泡灌洗液(BALF)的GM抗原检测诊断价值研究发现,BALF GM试验较血清GM和培养均有更好的诊断价值。Lu等的前瞻性研究发现,曲霉特异性IgG抗体可用于非粒缺IPA的辅助诊断,其诊断价值优于血清GM试验和培养。慢阻肺合并IPA患者亚组分析显示,曲霉特异性IgG抗体阳性率略低于BALF GM试验,但无显著差异(P=0.265)。因此,病情严重无法进行支气管镜检查获取BALF的慢阻肺患者,可进行曲霉特异性IgG抗体的检测。曲霉抗原抗体联合检测可以进一步提高曲霉病的诊断准确性。BALF聚合酶链反应(PCR)可用于IPA的诊断,但其对慢阻肺合并IPA的诊断价值尚无相关文献报道。He等建议可对怀疑曲霉感染但传统检测方法阴性的患者进行高通量测序(NGS),但不建议在慢阻肺合并IPA的患者中单独使用。PTX3基因多态性与慢阻肺患者的肺曲霉病易感性显著相关,有望作为慢阻肺合并IPA的高危人群筛查和辅助诊断。IPA是一种快速进展并严重威胁生命的疾病,指南建议抗曲霉治疗至少6~12周,但慢阻肺合并IPA患者的治疗疗程尚需进一步研究。慢阻肺患者有曲霉病相关临床表现和影像学特征,且抗菌药物充分治疗后症状无好转、病变未吸收的情况下,应积极进行培养、曲霉抗原抗体检测、血清或BALF GM试验等。结果阳性可先实施抗曲霉治疗。2007年文献报道,慢阻肺合并IPA患者的病死率高达95%,而近年来报道慢阻肺合并IPA患者的病死率有所下降,为43.3%~73%。这与临床医生的认识提高,及早地主动应用多种检测方法,提高早期诊断率,从而积极地给予抗真菌药物治疗有关。因此,对于慢阻肺急性加重,尤其是使用糖皮质激素和/或抗菌药物治疗的患者,要考虑曲霉感染可能。及时准确诊断疾病对降低慢阻肺合并IPA患者的病死率、预后改善至关重要。
CPA是一种进展性肺部疾病,常见于有结构性肺部疾病或轻度免疫抑制的患者,如结核感染后肺结构损伤、慢阻肺、囊性纤维化和支气管扩张等。30.6%~43.9%的CPA患者发生在慢阻肺人群。2015年欧洲发布全球首个《慢性肺曲霉病:理论基础和临床诊治》指南,该指南明确提出了CPA的五个主要亚型:单纯性肺曲球、慢性空洞性肺曲霉病(CCPA)、慢性纤维化肺曲霉病(CFPA)、曲霉结节、亚急性侵袭性曲霉病(SAIA)。国内一项研究发现CFPA和SAIA分型在慢阻肺患者中更为多见。
慢阻肺合并CPA的患者除有咳嗽、咳痰、喘息等与慢阻肺相似的临床表现外,其特征性表现为痰液性状改变和咯血/痰中带血。CPA影像学特征包括空洞形成、空洞壁增厚、实变、曲霉结节、支气管扩张和肺纤维化等,但其在慢阻肺患者中的表现缺乏相关报道。慢阻肺合并CPA患者的典型影像表现见图2。
慢阻肺合并CPA的早期诊断较为困难。曲霉特异性IgG抗体被广泛用于CPA的诊断。Li等研究发现血清曲霉特异性IgG抗体的水平变化趋势可以反映CPA患者长期的治疗效果,但其在慢阻肺合并CPA患者中的诊断价值尚不明确。使用未稀释或大量痰培养是CPA诊断的有效方法,但其敏感性低,易受污染。PCR较培养敏感性更高。Denning等利用PCR在71.4%的CPA患者痰中检出曲霉。对怀疑曲霉感染的慢阻肺患者可进行痰PCR辅助检测。宏基因组高通量测序(mNGs)对诊断慢阻肺合并CPA患者的价值有待进一步研究。痰和血清GM抗原检测暂不被推荐用于慢阻肺合并CPA的诊断。慢阻肺合并CPA的治疗是复杂的,合并不同类型CPA的治疗方法不同,必要时需多学科诊治。抗真菌治疗针对CCPA和SAIA可获得一定疗效,但在慢阻肺患者中的治疗需进一步研究。糖皮质激素作为慢阻肺患者的基本治疗方法,对能否改善合并CPA患者的症状和预后尚不明确。但由于糖皮质激素是CPA的危险因素,不建议对慢阻肺合并CPA的患者单独使用。对于肺功能尚可的单纯性肺曲霉球可通过手术切除,但慢阻肺终末期的患者不建议手术。经积极治疗后的CPA患者5年生存率可达到62%~92.1%,但慢阻肺的存在会显著影响生存率。
Lowes等发现慢阻肺合并CPA的患者较CPA患者2年生存率显著下降(P<0.001),在调整年龄、性别、潜在肺部疾病等多因素分析后,发现慢阻肺(风险比为1.57,95%CI为1.05~2.36,P=0.029)是CPA患者病死率的独立预测因子。因此,对慢阻肺患者进行曲霉感染筛查,积极干预疾病进程将有助于提高患者生存率。
ABPA是一种进展缓慢性免疫性呼吸系统疾病,涉及对气道中持续存在的曲霉(主要是烟曲霉)的高反应性应答,在慢阻肺中日益被认识。一项前瞻性病例对照研究(n=200)报道了1%的慢阻肺患者血清学检查提示患有ABPA。慢阻肺合并ABPA患者通常表现为咳嗽伴黏液样痰、喘息、呼吸困难等症状,影像学可见肺气肿、支气管扩张、浸润性改变等非特异性征象。慢阻肺合并ABPA患者的典型影像表现见图3。
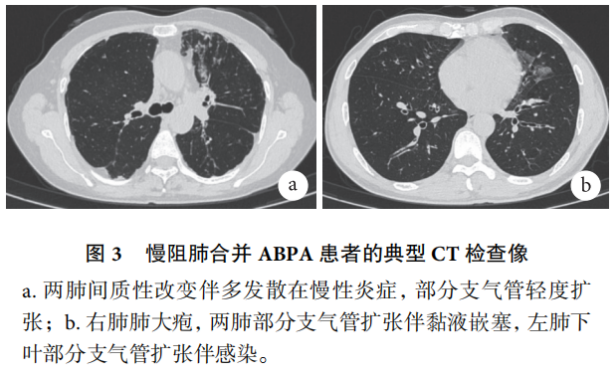
血清烟曲霉IgE和IgG抗体的升高常被用于慢阻肺合并ABPA的诊断。皮肤点刺试验因其敏感性低以及假阴性风险高,需结合烟曲霉特异性IgE抗体共同分析。Tetikkurt等考虑嗜酸性粒细胞增多且常规治疗无效的慢阻肺患者可能合并ABPA,建议进行曲霉检测,如GM试验和PCR等。
糖皮质激素常被用于慢阻肺合并ABPA患者的治疗,但对于年龄较大且基础疾病多、免疫功能差的患者不建议使用足量糖皮质激素。抗真菌治疗对哮喘/囊性纤维化合并ABPA的患者有显著效果,但在慢阻肺患者中的疗效尚不明确。目前,改进药代动力学的亚甲伊曲康唑、吸入类抗真菌药物以及新型液体雾化给药的唑类药物等正在开发中,有望推进慢阻肺合并ABPA患者的治疗发展。慢阻肺是ABPA患者死亡的独立危险因素。Zhang等报道了慢阻肺合并ABPA患者的1年、5年生存率分别为60%、40%。加强慢阻肺患者尤其是急性加重患者的曲霉检测,早发现、早治疗,可减少误诊,降低病死率。
曲霉致敏定义为皮肤点刺试验阳性和/或曲霉特异性IgE抗体升高,作为ABPA和真菌致敏的严重哮喘的诊断标准之一已被临床应用。近年来,在慢阻肺人群中,研究报道曲霉致敏率为8.5%~18%,笔者团队在前期研究中发现14.9%的慢阻肺患者合并曲霉致敏。皮肤点刺和曲霉特异性抗体检测两者具有较好的一致性。广谱抗菌药物和激素的应用增加了慢阻肺患者曲霉感染的风险,而病原检测等技术的发展提高了临床医生对曲霉感染在慢阻肺疾病中的认识。但对于缺乏曲霉感染典型临床症状(咯血等)、影像学表现(空洞、结节、新月征等)、检测阳性的慢阻肺患者,曲霉相关的急性加重往往被忽视。既往病例报道需要口服糖皮质激素治疗的频繁急性加重的慢阻肺患者,虽然常规筛查无曲霉定植及感染的证据,但患者曲霉特异性IgG抗体阳性,在常规治疗效果不理想的情况下,予抗曲霉治疗后临床气促症状显著改善,随访中急性加重次数减少,并且减少甚至停用了口服糖皮质激素。曲霉致敏与慢阻肺频繁加重、肺功能下降有关。Tiew等通过单因素分析证实曲霉致敏与慢阻肺频繁加重显著相关,根据年龄、性别、体重指数和吸烟史调整后的多因素分析进一步表明了这一关系(发病率比为2.29,95%CI为1.12~4.68,P<0.01),并且该研究首次将室内和室外环境确定为慢阻肺真菌暴露和致敏反应的关键来源。
曲霉特异性IgG抗体作为ABPA诊断和CPA诊断及病情评估指标得到了临床广泛应用。Everaerts等对烟曲霉IgG抗体定量分析发现慢阻肺患者烟曲霉IgG抗体水平显著高于健康人。Bafadhel等研究显示,128例稳定期慢阻肺烟曲霉IgG抗体阳性率为21.1%,排除47例痰曲霉阳性的患者后,有17.3%的患者烟曲霉IgG抗体阳性。曲霉特异性IgG抗体能否作为非ABPA非CPA非IPA的慢阻肺患者曲霉致敏的证据,这需要临床进一步研究探讨。对于曲霉致敏的慢阻肺患者的抗真菌治疗,目前尚无相关研究。在高度怀疑曲霉相关的慢阻肺急性加重且常规治疗疗效不佳的情况下,酌情经验性抗真菌治疗可作为临床选择。
Shahi等将曲霉定植定义为连续3个月从呼吸道分泌物(BALF、气管内、痰液)中获得一个或多个曲霉培养阳性,且无影像学改变和肺炎特征。慢阻肺是曲霉定植的危险因素。既往研究报道了8.33%~42%的慢阻肺患者痰培养曲霉阳性,以烟曲霉多见。吸入性糖皮质激素的使用增加了曲霉定植的风险。Tong等发现糖皮质激素的使用与慢阻肺患者的曲霉定植独立相关(比值比为4.685,95%CI为1.529~14.355),且曲霉定植组患者接受更高剂量的糖皮质激素,表明曲霉定植组患者病情加重的程度更严重。Wu等研究同样发现糖皮质激素的使用是曲霉定植的危险因素,且曲霉培养阳性组在稳定期吸入糖皮质激素的患者比例显著高于阴性组(65.4% vs 27.8%,P=0.001)。单变量分析和多变量分析均证实曲霉定植是慢阻肺患者急性加重的独立危险因素。糖皮质激素的使用、病情的急性加重与曲霉定植的增加形成一个恶性循环。曲霉定植与慢阻肺患者的临床症状差、肺功能下降和急性加重频率增加显著相关。Tong等发现曲霉定植组患者常伴有哮喘和啰音,且定植组患者肺功能更差[FEV1%预计值:(40.0±16.0)% vs(44.5±16.8)%]。Wu等发现,曲霉培养阳性组患者90 d内和180 d内复发加重率显著高于阴性组(90 d:19.2% vs 4.2%,P=0.029;180 d:23.1% vs 4.2%,P=0.010),两组间慢性阻塞性肺病评估测试评分有显著差异(P=0.001)。Huerta等发现曲霉培养阳性组患者住院天数显著高于阴性组[(7.5±5.0)d vs(11.8±9.2)d,P=0.02],这在后续的研究中也得到了验证。曲霉培养法敏感性低,仅使用培养法会低估定植率。研究发现在慢阻肺患者中联合培养、GM试验和PCR技术检测BALF,可增加曲霉检出率。Denning等曾在早期提出将下呼吸道分泌物(痰液或BALF)检测真菌种类的一种或多种阳性定义为真菌定植。同样,是否可以将排除曲霉相关疾病后的任一方法检测曲霉阳性定义为曲霉定植,暂无相关文献报道,有待进一步验证。由于检测方法以及临床标准的不同,曲霉定植的患者是否需要抗曲霉治疗仍需要深入研究。有研究指出,在检出曲霉、存在危险因素且伴肺炎特征的ICU患者中,应考虑抗真菌治疗。曲霉定植患者的短期预后差、病死率高,且后期更容易发展成CPA、IPA等曲霉病。因此,提高检测敏感性,尽早干预,将有助于曲霉相关疾病的诊治,改善预后。表1是慢阻肺合并不同类型肺曲霉病之间的对比。

慢阻肺发病率逐年增加,慢阻肺合并肺曲霉病也受到越来越多的关注。随着临床医生认识的提高和诊断技术的发展,例如曲霉抗原抗体的检测和PCR技术的应用,提高了曲霉检出率,使致敏和定植得到及时诊断,减少了误诊。此外,慢阻肺合并不同类型肺曲霉病患者的治疗方案应遵循个体化,抗曲霉治疗常被用于治疗合并IPA的患者,而糖皮质激素对合并ABPA的患者有效,却不能用于IPA患者。诊断技术的作用和治疗方案的疗程尚需更多的研究验证,曲霉在慢阻肺疾病进程中的临床意义将成为未来的研究趋势。
 后可发表评论
后可发表评论




 公众号
公众号
 客服微信
客服微信