登录方式
方式一:
PC端网页:www.rccrc.cn
输入账号密码登录,可将此网址收藏并保存密码方便下次登录
方式二:
手机端网页:www.rccrc.cn
输入账号密码登录,可将此网址添加至手机桌面并保存密码方便下次登录
方式三:
【重症肺言】微信公众号
输入账号密码登录
注:账号具有唯一性,即同一个账号不能在两个地方同时登录。
作者:任雁宏
一、血管炎的定义及分类
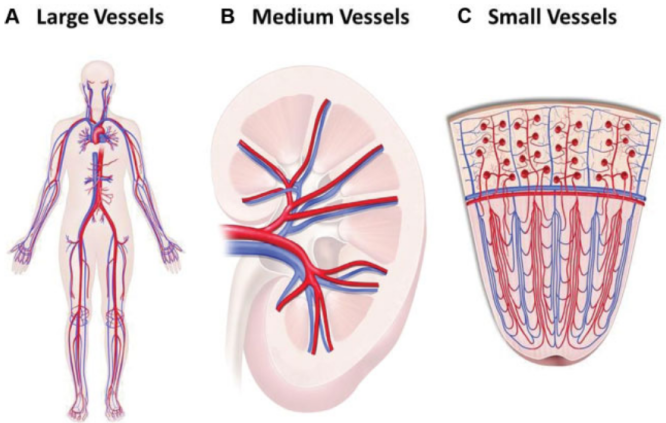
(1)大血管炎(large vessel vasculitis,LVV):巨细胞动脉炎,Takayasu动脉炎。【大血管是指主动脉及其主要分支和伴随静脉,多数大血管都在器官外,未进入器官内】
(2)中血管炎(medium vessel vasculitis,MVV):结节性多动脉炎,川崎病。【中血管是主要支配内脏的动、静脉及其最初的分支,进入到脏器中,它们是主要的供血血管或引流血管,但没有继续向组织内部细分】
(3)小血管炎(small-vessel vasculitis,SVV):①ANCA相关性血管炎:显微镜下多血管炎,肉芽肿性多血管炎(韦格纳肉芽肿),嗜酸性肉芽肿性多血管炎(Churg-Strauss)。②免疫复合物小血管炎:抗肾小球基底膜(抗-GBM)病,冷球蛋白性血管炎,IgA血管炎(过敏性紫癜),低补体荨麻疹性血管炎(抗-C1q血管炎)。【小血管是组织间的小动脉、毛细血管及小静脉,通常所说的小血管炎就是累及这一部位】
(4)变异性血管炎(variable vessel vasculitis,VVV):Behçet′s病,Cogan′s综合征。
(5)单一脏器血管炎(single-organ vasculitis,SOV):皮肤白细胞破碎性血管炎,皮肤动脉炎,原发神经系统血管炎,单纯性主动脉炎。
(6)系统性疾病相关血管炎(vasculitis associated with systemic disease):红斑狼疮血管炎,类风湿关节炎血管炎,结节病血管炎。
(7)病因学相关血管炎(vasculitis associated with probable etiology):乙肝病毒相关冷球蛋白血症性血管炎,丙肝病毒相关血管炎,梅毒相关主动脉炎,血清病相关免疫复合物相关血管炎,药物相关免疫复合物相关血管炎,肿瘤相关血管炎。

(1)结节性多动脉炎:中小血管的坏死性血管炎,不包括肾小球肾炎或微小动、静脉和毛细血管,而且与ANCA不相关。
(2)川崎病:主要累及中小血管,也可累及冠状动脉、主动脉等大血管,表现为皮肤黏膜淋巴结综合征,故有时也被称为皮肤黏膜淋巴结综合征血管炎。
(1)显微镜下多血管炎(MPA):坏死性血管炎,寡或无免疫复合物沉积,无肉芽肿性炎症,主要累及小动脉、毛细血管和小静脉,也可累及中动脉,坏死性肾小球肾炎和肺泡炎常见。
(2)肉芽肿性多血管炎(GPA):为坏死性肉芽肿性炎症,主要影响上、下呼吸道,累及小到中血管,坏死性肾小球肾炎常见,眼部血管炎和出血性肺泡炎很常见。
(3)嗜酸性肉芽肿性血管炎(EGPA):主要影响呼吸道,坏死性血管炎主要累及小到中血管,常伴有哮喘和高嗜酸细胞血症,鼻息肉常见。有肾小球肾炎时ANCA(+)频率高。该病以血液和组织中嗜酸细胞增高为基本特征。很多患者仅有上、下呼吸道受累,而无肾小球肾炎。血管外的肉芽肿和非肉芽肿炎症,如肺、心脏、消化道的嗜酸细胞性非肉芽肿性炎症常见。


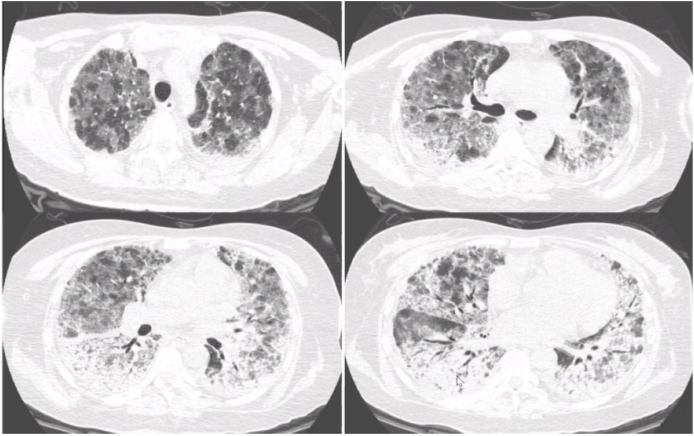
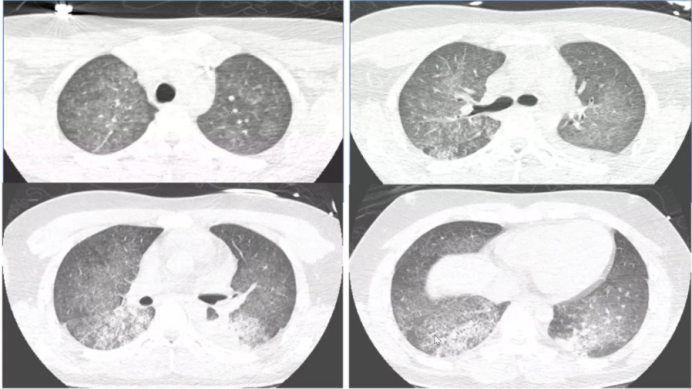
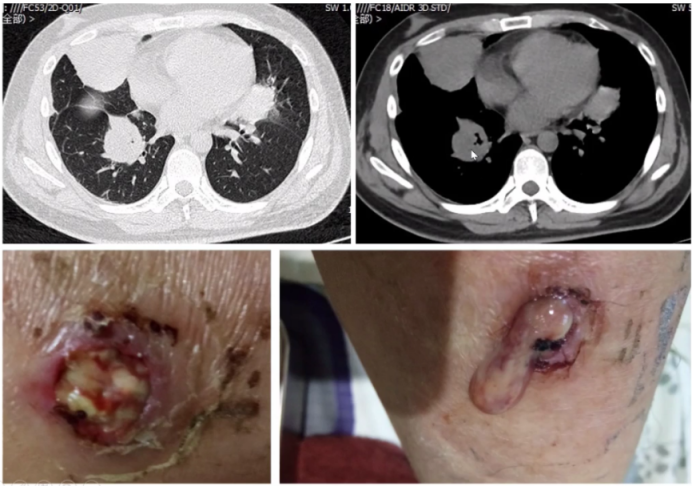
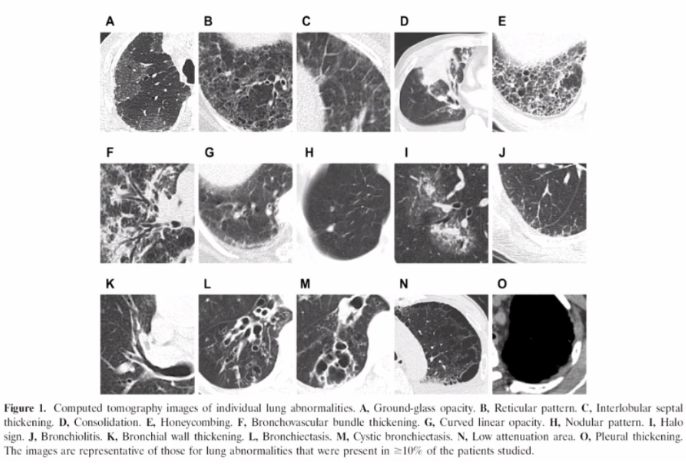
为何MPA在肺内的表现多样,而GPA表现相对单一呢?文献报道,当明确诊断MPA肺受累后,通过外科活检获取组织标本进行观察,真正能找到血管炎证据的非常少,起初我们也认为肺的损伤应是血管炎表现,但实际上并非如此。因此,血管炎直接累及肺以后导致血管破坏进而引起肺内病变,这种假说受到了质疑。随后也有学者开展了相关基础研究加以证实。由于MPA产生了抗髓过氧化物酶抗体抗体,当过氧化物酶与其相应抗体之间相互作用时,可以激发炎症反应,进而产生氧化应激产物或细胞因子等,这些因子随着血液循环游走于全身,已有体外研究证实了这些活性产物可能使肺内的成纤维细胞向肌成纤维细胞分化,这也是很多纤维化性间质性肺疾病发展到一定时期后的共同途径,包括特发性肺间质纤维化(IPF)。所以,有很多假说认为,MPA不是由血管直接损伤所导致,而是由于炎症反应后在肺内形成了一种慢性的结构破坏,这与其他类型纤维化疾病类似,尽管它们的成因不一定相同。而GPA肺受累,大多是血管破坏后所形成,其影像表现多为实性肿块,内有坏死、空洞形成。在MPA患者中,有97%以上的患者会出现1种以上肺受累表现,66%的肺受累表现为间质性改变,磨玻璃影、网格影、实变影是最常见的影像学表现。

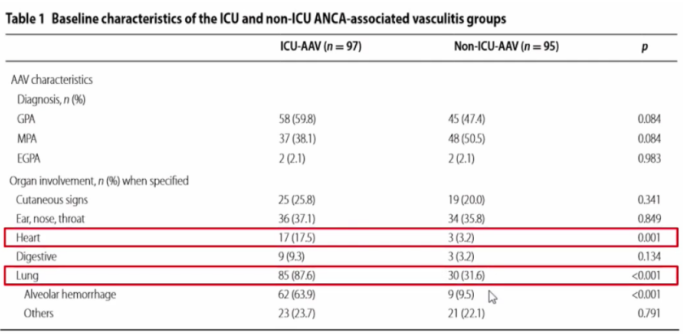


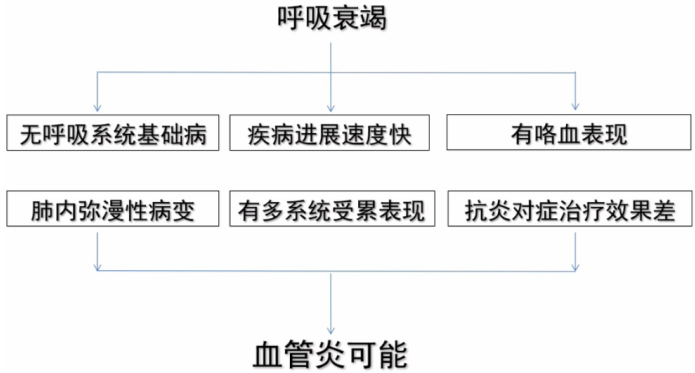
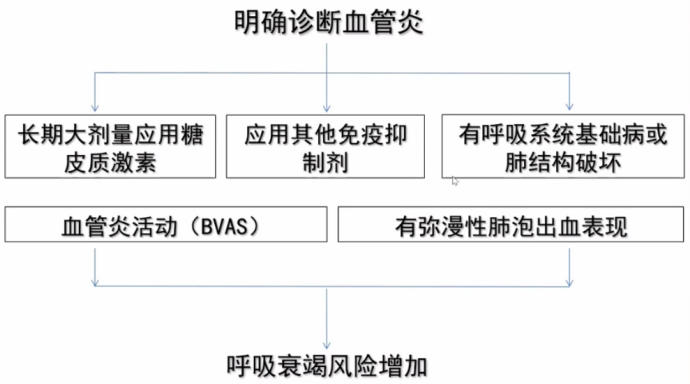
对于没有明确诊断的患者,如出现病情急性加重,无呼吸系统基础疾病,病情快速进展,有咯血,肺内弥漫性病变,出现多系统受累表现,前期抗感染治疗效果欠佳,伴ESR或CRP明显增高,需考虑血管炎的可能。如果已经明确血管炎的诊断,在治疗过程中病情又出现了新的变化,首先考虑基础疾病是否进展,另外考虑治疗过程中是否合并感染,因为这两种情况往往同时存在。
参考文献
[1] Jennette J C, Falk R J, Bacon P A, et al. 2012 revised International Chapel Hill Consensus Conference Nomenclature of Vasculitides[J]. Arthritis Rheum, 2013, 65(1):1-11.
[2] Khan S A, Subla M R Behl D, et al. Outcome of patients with small-vessel vasculitis admitted to a medical ICU[J]. Chest, 2007, 131(4):972-976.
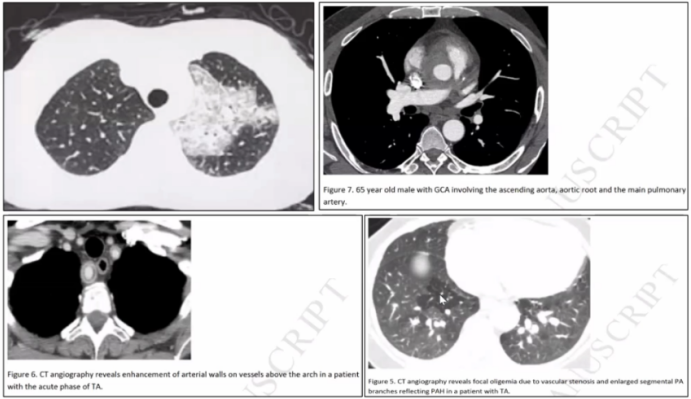
[3] Adams T N, Zhang D, Batra K, et al. Pulmonary manifestations of large, medium, and variable vessel vasculitis[J]. Respir Med, 2018, 145:182-191.
[4] Ferris E J. Pulmonary hemorrhage. Vascular evaluation and interventional therapy[J]. Chest, 1981, 80(6):710-714.
[5] Cilli A, Ozdemir T, Oğüş C. Takayasu's arteritis presenting with bilateral parenchymal consolidations and severe respiratory failure[J]. Respiration, 2001, 68(6):628-630.
[6] Sun K, Fisher J H, Pagnoux C, et al. Interstitial Lung Disease in ANCA-Associated Vasculitis: Pathogenic Considerations and Impact for Patients' Outcomes[J]. Curr Rheumatol Rep, 2022, 24(8):259-267.
[7] Yamagata M, Ikeda K, Tsushima K, et al. Prevalence and Responsiveness to Treatment of Lung Abnormalities on Chest Computed Tomography in Patients With Microscopic Polyangiitis: A Multicenter, Longitudinal, Retrospective Study of One Hundred Fifty Consecutive Hospital-Based Japanese Patients[J]. Arthritis Rheumatol, 2016, 68(3):713-723.
[8] Holguin F, Ramadan B, Gal A A, et al. Prognostic factors for hospital mortality and ICU admission in patients with ANCA-related pulmonary vasculitis[J]. Am J Med Sci, 2008, 336(4):321-326.
[9] Khan S A, Subla M R, Behl D, et al. Outcome of patients with small-vessel vasculitis admitted to a medical ICU[J]. Chest, 2007, 131(4):972-976.
[10] Cartin-Ceba R, Diaz-Caballero L, Al-Qadi M O, et al. Diffuse Alveolar Hemorrhage Secondary to Antineutrophil Cytoplasmic Antibody-Associated Vasculitis: Predictors of Respiratory Failure and Clinical Outcomes[J]. Arthritis Rheumatol, 2016, 68(6):1467-1476.
[11] Quartuccio L, Bond M, Isola M, et al. Alveolar haemorrhage in ANCA-associated vasculitis: Long-term outcome and mortality predictors[J]. J Autoimmun, 2020, 108:102397.
[12] Comarmond C, Crestani B, Tazi A, et al. Pulmonary fibrosis in antineutrophil cytoplasmic antibodies (ANCA)-associated vasculitis: a series of 49 patients and review of the literature[J]. Medicine (Baltimore), 2014, 93(24):340-349.
[13] Schirmer J H, Wright M N, Vonthein R, et al. Clinical presentation and long-term outcome of 144 patients with microscopic polyangiitis in a monocentric German cohort[J]. Rheumatology (Oxford), 2016, 55(1):71-79.
[14] Chen M, Yu F, Zhang Y, et al. Antineutrophil cytoplasmic autoantibody-associated vasculitis in older patients[J]. Medicine (Baltimore), 2008, 87(4):203-209.
[15] Badsha H, Kong K O, Lian T Y, et al. Low-dose pulse methylprednisolone for systemic lupus erythematosus flares is efficacious and has a decreased risk of infectious complications[J]. Lupus, 2002, 11(8):508-513.
[16] Krause M L, Cartin-Ceba R, Specks U, et al. Update on diffuse alveolar hemorrhage and pulmonary vasculitis[J]. Immunol Allergy Clin North Am, 2012, 32(4):587-600.
作者简介
中日友好医院呼吸与危重症科副主任医师,博士
中华医学会呼吸病学分会间质性肺疾病学组秘书
中国医师协会呼吸医师分会间质病学组委员
作为负责人和主要参与人员承担国家自然科学基金项目2项,国家973科技计划课题1项
2010年入选北京市科技新星计划
作为主要成员获得国家科技进步奖二等奖1项
参与编写《呼吸治疗》《呼吸重症监护治疗病房医生工作手册》
在N Engl J Med、Anathesesia、Respiration、Thorac Cancer等杂志发表多篇研究论文
主要专业方向为间质性肺疾病、肺部及胸膜肿瘤
*本文根据重症肺言“空中大查房”第四十一期专题视频整理,感谢任雁宏教授予以审核。
 后可发表评论
后可发表评论




友情链接
联系我们
 公众号
公众号
 客服微信
客服微信