登录方式
方式一:
PC端网页:www.rccrc.cn
输入账号密码登录,可将此网址收藏并保存密码方便下次登录
方式二:
手机端网页:www.rccrc.cn
输入账号密码登录,可将此网址添加至手机桌面并保存密码方便下次登录
方式三:
【重症肺言】微信公众号
输入账号密码登录
注:账号具有唯一性,即同一个账号不能在两个地方同时登录。
作者:赵洪文
单位:中国医科大学附属第一医院
一、脓毒症概述
脓毒症是宿主对感染的反应失调,引起危及生命的器官功能障碍。脓毒症休克是指感染导致的循环、细胞、代谢的明显异常,是脓毒症的一个亚型,其诊断标准是:脓毒症患者经过积极的液体复苏后仍然需要升压药来维持平均动脉压(MAP)≥65 mmHg,且血乳酸>2 mmol/L[1]。
为了更好地治疗脓毒症,拯救脓毒症运动(Surviving Sepsis Campaign,SSC)制定了治疗脓毒症的“Bundle”,从6小时“Bundle”升级为3小时“Bundle”,2018年更新为1小时“Bundle”[2],这也体现了脓毒症是一种急症,需要快速处理。2018年“Bundle”包括:①测定乳酸,若初始乳酸>2 mmol/L,2~4小时再次测量;②使用广谱抗生素前要进行培养,获取病原学依据;③如果出现低血压或乳酸>4 mmol/L,即应开始快速输注至少30 ml/kg晶体液(3 h内完成),进行液体复苏;④如果液体复苏期间或复苏之后出现低血压,应启动血管加压药来维持MAP≥65 mmHg。
二、脓毒症微循环障碍机制
因此,对于脓毒症患者,大循环和微循环受累后,仅改善大循环,无法缓解器官功能障碍,微循环不改善,患者预后也不会理想。如果单纯通过监测MAP、中心静脉压(CVP)、心输出量等指标来评估大循环的受累情况,远远不够。所以,微循环障碍已经成为判断脓毒症预后的重要依据,评估和改善微循环是脓毒症关注的热点[6]。
三、微循环的构成
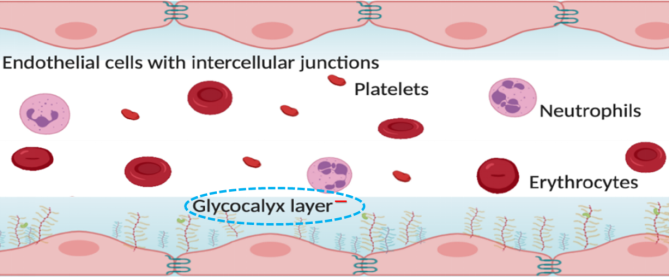
四、脓毒症时微循环的表现
当发生脓毒症时,会出现灌注血管密度减少,血流灌注区域异质性增加,血流分布发生异常改变,血流速度减慢、间断或停止。另外,还可出现毛细血管通性增加,组织水肿,毛细血管和细胞间的间距增加,可使动脉血管肌张力降低,直至血管瘫痪,也可以出现继发性动-静脉短路开放。此外,红细胞变形能力和弹性减弱,血小板聚集增加,血黏度增加及纤维蛋白形成,引起微血栓,进而造成小血管闭塞[8,9]。
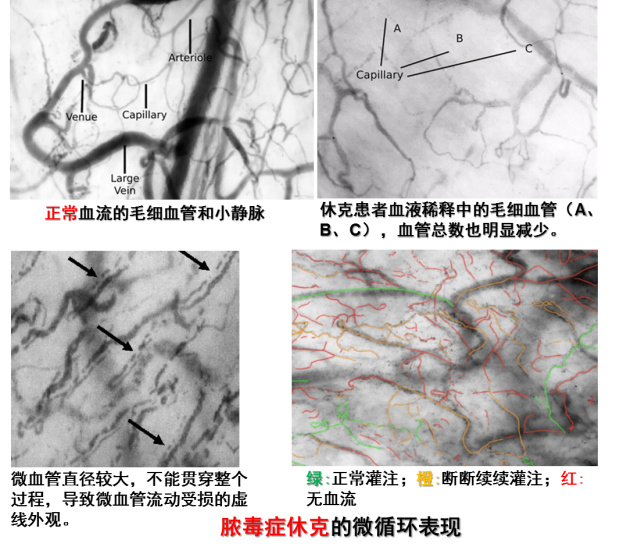
如下图所示,正常毛细血管非常光滑,也比较密集,而休克患者的毛细血管稀疏,而且血管总量减少,出现断断续续的血流,导致微血管流动受损。红色代表没有血流的微血管,橙色代表断断续续的灌注,绿色属于正常血管。
五、微循环灌注的监测目标
通过SDF检测的参数包括总血管密度(TVD)、灌注血管密度(PVD)、灌注血管比例(PPV)、微血管血流指数(MFI)以及不均一指数(HI)。当发生脓毒症时,TVD、PVD、PPV、MFI均下降,HI升高。这些指标的变化在死亡患者中更明显,如果复苏后第一个24小时这些改变仍然存在,则与死亡密切相关,是独立危险因素。如果干预后这些指标迅速改善,提示患者预后可能会较好。
六、小结
参考文献
[1] Singer M, Deutschman C S, Seymour C W, et al. The Third International Consensus Definitions for Sepsis and Septic Shock (Sepsis-3)[J]. JAMA, 2016, 315(8):801-810.
[2] Levy M M, Evans L E, Rhodes A. The Surviving Sepsis Campaign Bundle: 2018 Update[J]. Crit Care Med, 2018, 46(6):997-1000.
[3] Sakr Y, Dubois M J, acker D D, et al. Persistent microcirculatory alterations are associated with organ failure and death in patients with septic shock[J]. Crit Care Med, 2004, 32(9):1825-1891.
[4] Backer D D, Donadello K, Sakr Y, et al. Microcirculatory alterations in patients with severe sepsis: impact of time of assessment and relationship with outcome[J]. Crit Care Med, 2013, 41(3):791-799.
[5] Gruartmoner G, Mesquida J, Ince C, et al. Microcirculatory monitoring in septic patients: Where do we stand?[J]. Med Intensiva, 2017, 41(1):44-52.
[6] Yajnik V, Maarouf R. Sepsis and the microcirculation: the impact on outcomes[J]. Cruu Opin Anesthsiol, 2022, 35:230-235.
[7] do Amaral Tafner P F, Chen F K, Filho R R, et al. Recent advances in bedside microcirculation assessment in critically ill patients[J]. Rev Bras Ter Intensiva, 2017, 29(2):238-247.
[8] Backer D D, Ricottilli F, Ospina-Tascón G A. Septic shock: a microcirculation disease[J]. Cruu Opin Anesthsiol, 2021, 34:85-91.
[9] Siegemund M, Hollinger A, Gebhard E C, et al. The value of volume substitution in patients with septic and haemorrhagic shock with respect to the microcirculation[J]. Swiss Med Wkly, 2019, 149:w20007.
[10] 刘大为, 王小亭, 张宏民, 等. 重症血流动力学治疗—北京共识 [J] . 中华内科杂志, 2015, 54 (3): 248-271.
[11] Devia Jaramillo G, Castro Canoa J, Valverde Galván E. Approach of minimal invasive monitoring and initial treatment of the septic patient in emergency medicine[J]. Open Access Emerg Med, 2018, 10:183-191.
[12] Ince C. The microcirculation is the motor of sepsis[J]. Critical Care, 2005, 9(suppl 4):S13-S19.
作者简介
赵洪文 教授
医学博士,教授,博士生和博士后导师,辽宁省特聘教授
中国医科大学附属一院呼吸与危重症医学科副主任、MICU主任
曾两次赴美学习,承担两项国家自然基金课题,发表论文70余篇
辽宁省医学会结核病学分会第二届委员会副主委
辽宁省医师协会呼吸医师分会第一届委员会副会长
辽宁省细胞生物学学会重症医学专业委员会副主委
沈阳市医师协会呼吸科医师分会副主委
辽宁省医学会呼吸病学分会第8届委员会重症学组组长
辽宁省医学会重症医学分会第1~4届委员会委员
中华医学会呼吸病学分会第7~10届委员会呼吸危重症学组委员
中华医学会呼吸病学分会第11届委员会感染学组委员
中国医师协会呼吸医师分会危重医学工作委员会委员
《中华内科杂志》通讯编委,《中国实用内科杂志》《国际呼吸杂志》编委
 后可发表评论
后可发表评论




友情链接
联系我们
 公众号
公众号
 客服微信
客服微信