登录方式
方式一:
PC端网页:www.rccrc.cn
输入账号密码登录,可将此网址收藏并保存密码方便下次登录
方式二:
手机端网页:www.rccrc.cn
输入账号密码登录,可将此网址添加至手机桌面并保存密码方便下次登录
方式三:
【重症肺言】微信公众号
输入账号密码登录
注:账号具有唯一性,即同一个账号不能在两个地方同时登录。
作者:雷伟
单位:苏州大学附属第一医院呼吸与危重症医学科
霉菌感染发病率呈升高趋势,且患者病死率高。在ICU患者中,IFD病因中,曲霉与其他霉菌感染比例呈增高趋势[4]。与其他IFD患者相比,毛霉病及IA患者病死率相对较高[7]。
免疫功能与曲霉病密切相关,随着免疫功能的降低,患者更易进展为IA。近年来,IA发病率不断增加,恶性血液病、造血干细胞移植(HSCT)、实体器官移植(SOT)、慢阻肺、使用激素或免疫抑制剂、病毒感染、接受靶向药物治疗是IA的重要危险因素。肺部是IA患者最主要的感染部位,其次为鼻窦、中枢神经系统,IA能够显著增加患者的病死率,延长住院时间,加重了经济负担。
我们对毛霉病的认识相对较少。毛霉病是由毛霉目病原体引起的罕见的侵袭性真菌病[8]。
毛霉病的发病机制[9]:通过孢子吸入鼻孔或肺部或接触到皮损或伤口而发生感染;高血糖和酸中毒损伤吞噬细胞的趋化性和杀伤能力,易发生毛霉病;脱铁胺作为毛霉载体增加真菌的生长,因此铁超载时易发生毛霉病。
全球范围内,毛霉病疾病负担重,且发病率不断增加。预估全球毛霉病的发病率为0.005~1.7/100万人[10];在印度,毛霉病患病率为14/10万人,约为发达国家的80倍[11],且印度毛霉病发病率不断增加[10]。欧洲地区毛霉病疾病负担最高,印度地区毛霉病患者数量最多[12]。
糖尿病、激素治疗、血液恶性肿瘤、器官移植、肾功能不全、使用广谱抗细菌药物等多种因素与毛霉病的发生密切相关。
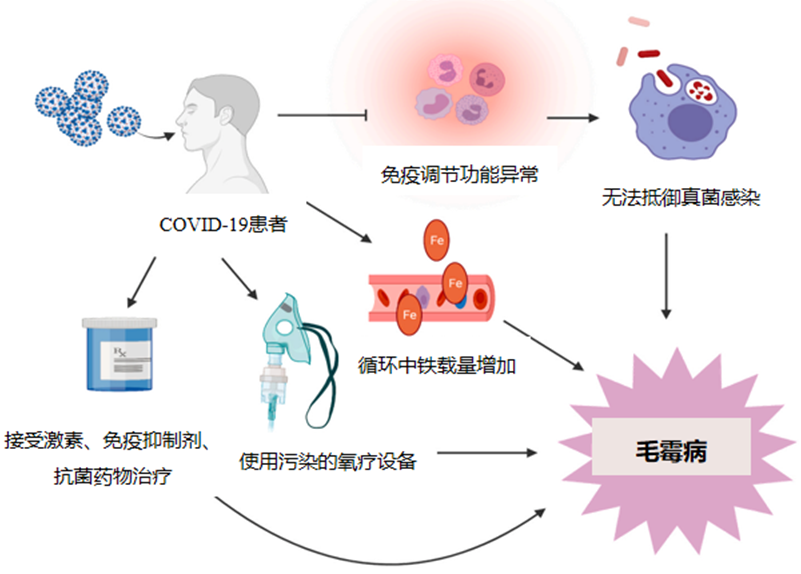
近期流行的COVID-19亦是毛霉病的重要危险因素。免疫功能抑制、铁载量增加、使用激素治疗、氧疗设备的污染等导致COVID-19患者易发生毛霉病[12]。
数据显示:鼻-眼-脑毛霉病、肺毛霉病是常见的毛霉病类型,其次包括皮肤软组织毛霉病、胃肠道毛霉病、播散性毛霉病等[9]。
不同基础疾病患者毛霉病感染的部位不同。
毛霉病进展迅速,若未及时治疗患者病死率高。大多数情况下,除非及时进行手术和抗真菌治疗,否则毛霉病患者病情会迅速恶化,并最终死亡;这种情况下,毛霉病患者病死率达54%,且很大程度上取决于感染部位、潜在的基础疾病和真菌类型。
全球范围内,毛霉病疾病负担重,且发病率不断增加。糖尿病、激素治疗、血液恶性肿瘤、COVID-19等多种因素与毛霉病的发生密切相关。不同基础疾病患者毛霉病发病率存在一定差异,鼻眶脑、肺是毛霉病的高发部位;不同基础疾病患者,毛霉病感染的部位同样存在一定差异。毛霉病进展迅速,若未及时治疗,患者的病死率较高。
IFD的诊断分为确诊、临床诊断、拟诊和未确定四个级别[13]。
国内外IFD相关指南均明确指出:临床诊断和确诊的依据必须包括病原微生物的实验室检查,其中实验室检查是诊断标准极为重要的组成部分。目前多种方法可用于IFD的诊断。
IA的确诊标准是无菌部位培养、组织核酸检测。
临床诊断IA时,患者需符合1项宿主因素、1项临床标准和1项微生物学标准。
侵袭性肺曲霉病的影像学有多种表现,是从非特征性的气道病变逐渐演变为特征性的血管侵袭为主[14]。曲霉菌侵袭累及肺泡和细支气管壁,影像学可呈现非特征性改变,如支气管周围实变影、支气管扩张征、小叶中心型微小结节影、树芽征和磨玻璃样改变等表现,为曲霉菌气道侵袭特征性表现;侵袭性肺曲霉病的特征性CT影像学包括:致密、边界清楚的病变(伴或不伴晕征)、空气新月征、空洞、楔形/节段性或大叶性病灶[13]。
侵袭性曲霉病患者可出现特征性或非特征性CT改变,且疾病不同阶段CT表现存在一定差异。侵袭性肺曲霉病CT表现与免疫缺陷类型或程度及潜在宿主疾病相关,严重免疫抑制时免疫反应极为有限;而免疫恢复/重建时,反应将增加、病变可能会扩大,边界清晰的病变(结节)是侵袭性肺曲霉病的主要影像学表现;不同影像学表现可能代表疾病的不同阶段[15]。针对免疫缺陷患者,侵袭性肺曲霉病的CT特征随疾病进展而有不同表现:疾病早期以晕轮征为主,随后以空气新月征、空洞常见[16];此外,患者初期病变数量及大小增加,随后进入减少的平稳阶段[17]。IA患者还可表现为非特异性和不常见的CT改变,如实变、空洞性病变、胸腔积液、磨玻璃样混浊、树状浸润性病变和肺不张等,但非特异性CT可能会进展为特异性表现。
一项针对252例血液病患者的研究结果显示:G试验和GM试验诊断IA的敏感性、特异性、阳性预测值和阴性预测值均较高,BALF GM试验诊断IA的准确性较高,且与血GM检测结果相当[18]。与血液病患者不同,G试验和GM试验在诊断非血液病患者IA时的敏感性和阳性预测值相对较低,但其特异性及阴性预测值仍较高[19]。针对呼吸科等非血液病患者,BALF G试验和GM试验诊断IA时表现出较高的敏感性、特异性、阳性预测值和阴性预测值[20]。因此,BALF G试验和GM试验则在诊断非血液病患者侵袭性曲霉病时表现出较高的诊断价值。
近年来,PCR检测血液和BALF已被指南推荐为临床诊断侵袭性曲霉病的真菌学标准;目前,临床中曲霉PCR检测主要被用于疑似IA患者的确诊或筛查IA高风险人群,以促进早期诊断。25项研究的荟萃分析发现,血清PCR检测的敏感性和特异性分别为84%和76%;此外,至少有两次PCR检测结果阳性时的特异性高达95%,敏感性为64%,高似然比为12.8。17项研究的荟萃分析及系统汇总:BALF-PCR检测诊断确诊及临床诊断IA的敏感性及特异性分别达91%和92%;阳性似然比为11.90,阴性似然比为0.10。
近年来,NGS被逐渐用于IA等感染性疾病的诊断,但其仍存在一定的局限性。最新指南明确指出,二代测序对真菌的检出率显著高于培养;以临床诊断为金标准,二代测序比培养显著提高了灵敏度(50.7% vs 35.2%),而特异度无显著区别。对于新发、罕见、疑难感染性疾病,以及免疫缺陷患者,二代测序能显著提高病原体的检出率,可作为上述疾病的一线检测方法[21]。
NGS检测IA时存在一定的局限性:①敏感度与人源背景微生物水平相关;②临床标本来源复杂多样,可能存在病原体信息太少而导致数据丢失或数据混杂;③缺乏标准数据;缺乏统一的数据分析流程;④数据库的完整性及准确性参差不齐,且检测人员及技术水平对mNGS的结果亦存在影响;⑤NGS检测技术的局限性;⑥多数mNGS检测需在第三方实验室集中检测,样本寄送耗时较长;⑦价格昂贵、基因量少等。
多次生物标志物检测或联合检测在高危患者中筛查侵袭性曲霉病具有较高的诊断阳性率。一项荟萃分析结果显示:使用至少1个GM试验或PCR阳性结果确定阳性的敏感性高达99%,且结果显著高于任何单一试验(与GM试验相比,P=0.0018;与PCR相比,P<0.0001)。此外,当同一患者的GM试验和PCR均为阳性时,其诊断特异性增高至98%[22]。该研究证实:单次GM试验或PCR检测阳性对筛查高危患者的侵袭性曲霉病性能欠佳,但具有较高的阴性预测值;当至少2次阳性结果时阳性预测值可达88%。
但临床中多种因素影响G试验、GM试验结果的准确性。因此,影像学联合微生物学有助于侵袭性肺曲霉病的早期诊断。一项针对141例侵袭性肺曲霉病患儿的回顾性分析:GM试验联合CT诊断的敏感性、特异性、阳性预测值及阴性预测值分别为79.3%、85.2%、76.4%和87.2%;且与血清GM试验、CT检查相比,GM试验联合CT检查的AUC值最高。另一项针对113例成人IPA患者的研究结果显示:GM试验联合CT诊断的敏感性与单纯GM试验检测相当,而特异性则明显提升。
与IA的确诊标准相同,无菌部位培养、组织核酸检测是确诊毛霉病的标准。临床诊断侵袭性毛霉病(IM)时,患者需符合1项宿主因素、1项临床标准和1项微生物学标准。
不同毛霉病患者出现不同的临床表现,主要取决于宿主的免疫状态、感染程度和受累器官。
毛霉病最常表现为鼻眶脑感染,通常发生于真菌孢子吸入鼻窦;这种情况下,感染可能停留在局部,症状与急性鼻窦炎类似:伴发热、头痛、鼻窦疼痛和鼻塞。毛霉病也可表现为吸入孢子后肺部感染;常见发热,胸痛,呼吸困难和咯血(可能是大量和致命的),咯血主要是由于菌丝侵犯血管和随后出血。免疫功能低下患者中,毛霉菌感染可能侵犯眼眶和上颚,并进一步延伸到大脑;局部组织侵犯可导致显著的临床异常,包括视力丧失、颅神经麻痹和精神状态改变。皮肤毛霉病患者多数无明显的免疫抑制,但既往有严重创伤;感染可局限于局部或扩展到更深的组织,包括周围的骨骼、肌肉和肌腱;病变开始时出现疼痛的红斑和硬化,并逐渐发展为坏死,通常进展为坏死性筋膜炎。在COVID-19患者中,毛霉病主要影响眼睛、口腔和大脑;常表现为眼部干性坏疽;眶鼻区、上颚或口腔底的压疮等。
反晕轮征是毛霉菌病的一种特异性征象。既往多项研究及病例报道提示,针对免疫功能不全患者中,反晕轮征内的网状结构和较厚的外缘强烈提示患者可能为毛霉菌病[23]。既往研究报道称,19%~94%的肺毛霉菌病患者的影像学表现为反晕轮征,且反晕轮征在粒缺患者中更为常见[24, 25];此外,毛霉病的连续胸部X线片检查显示出快速的进展[24]。
肺毛霉菌病的影像学表现多种多样,且常为非特征性表现。
《宏基因组高通量测序技术应用于感染性疾病病原检测中国专家共识》指出[26]:mNGS通过对临床样本的DNA或RNA进行鸟枪法测序,可以无偏倚地检测毛霉菌等多种病原微生物。针对毛霉菌等细胞壁比较厚的病原体,常规核酸提取方法难以保证核酸提取的质量,因此需要使用一些特殊的破壁方法,并标准化。对于在核酸提取过程中破壁困难的微生物,如毛霉菌等,应注意mNGS提供的线索,进一步确认与排除;即使在检测报告中读长数较低,也要考虑其为致病微生物的可能,并采用其他方法验证,如特异引物的PCR或一代测序等分子生物学检测。
无菌部位培养、组织核酸检测是确诊霉菌病的标准。临床诊断霉菌病时,患者需符合1项宿主因素、1项临床标准和1项微生物学标准。
侵袭性曲霉病的临床诊断:
毛霉病的临床诊断:
目前常用的抗真菌药物主要包括:多烯类(两性霉素B、两性霉素B脂质体及复合物)、三唑类(氟康唑、伊曲康唑、伏立康唑、泊沙康唑)、棘白菌素类(卡泊芬净、米卡芬净)。多烯类药物通过与真菌细胞膜上固醇结合,导致细胞内容物通过这些孔道渗漏,从而发挥抗真菌活性。三唑类药物通过抑制CYP14-α去甲基化酶抑制真菌细胞膜中麦角固醇的合成。棘白菌素通过非竞争性抑制(1,3)-β-D-葡聚糖的合成从而破坏细胞壁完整性,进而导致细胞溶解。
1. 侵袭性霉菌感染治疗未满足的需求
棘白菌素对毛霉菌无抗菌活性,对曲霉菌的抗菌活性中等,治疗IA的应答率和生存获益均较低,故指南不推荐其为IA首选治疗方案。
棘白菌素作为侵袭性感染的首选治疗数据有限。研究显示,使用卡泊芬净治疗24位异基因造血干细胞移植患者,12周仅42%的患者完全或部分应答,12周生存获益50%。然而在第二阶段进行的研究中显示,在61例血液病患者中给予卡泊芬净初始仅在20例患者中成功(33%)。基于这些有限的研究数据,不推荐棘白菌素作为侵袭性曲霉病常规初始单药治疗[27-29]。
两性霉素B脂质体(L-AmB)治疗毛霉病指南一线推荐,同时强调剂量达标;对土曲霉无抗菌活性,颅脑穿透力不足。2019 ECMM毛霉病的诊断和管理指南推荐:在所有系统感染中,优先推荐两性霉素B脂质体5~10 mg/(kg/d)进行一线治疗,应该开始就应用最大剂量,不应缓慢增加剂量[30]。两性霉素B说明书中推荐剂量达不到指南推荐剂量标准。
硫酸艾沙康唑具有安全性优势,并且药物相互作用较少。对比伏立康唑,硫酸艾沙康唑的安全性更好,眼部、皮肤和肝胆异常的药物相关的治疗期间不良反应(TEAE)显著减少,药物-药物相互作用更少,对IA和IM都有效,减少TDM需求,肾功能损害患者安全可用。
与泊沙康唑相比,硫酸艾沙康唑对IA和IM都有效,是指南推荐治疗IA的一线用药,具有线性药代动力学特性,较少需要TDM,口服生物利用度为98%。与两性霉素B脂质体相比,硫酸艾沙康唑对于肾功能损害患者更加安全,低钾血症发生率低,输液部位反应少,对IA(包括土曲霉)和IM均有效,口服制剂。
指南推荐治疗侵袭性曲霉病的药物选择如下表[27, 31-34]。
指南推荐治疗毛霉病的药物选择见下表。
随免疫功能降低,患者易进展为侵袭性曲霉病。近年来侵袭性曲霉病发病率不断增加;全球范围内,毛霉病疾病负担重,且发病率不断增加;肺部是IA患者最主要的感染部位,其次为鼻窦、中枢神经系统;鼻眶脑、肺是毛霉病的高发部位。IA显著增加患者病死率,延长住院时间,加重经济负担;毛霉病进展迅速,若未及时治疗患者病死率高。
无菌部位培养、组织核酸检测是确诊霉菌病的标准。
侵袭性曲霉病/毛霉病的临床诊断标准:临床诊断霉菌病时,患者需符合1项宿主因素、1项临床标准和1项微生物学标准。
国外指南A-I级推荐艾沙康唑治疗侵袭性曲霉病。指南中度推荐艾沙康唑治疗IM,强烈推荐用于肾功能损伤及其他抗真菌药物不耐受的患者(A类推荐)。
⭐ 参考文献
[1] Buil J B, Meijer E F J, Denning D W, et al. Burden of serious fungal infections in the Netherlands[J]. Mycoses, 2020, 63(6):625-631.
[2] Li Z, Li Y, Chen Y, et al. Trends of pulmonary fungal infections from 2013 to 2019: an AI-based real-world observational study in Guangzhou, China[J]. Emerg Microbes Infect, 2021, 10(1):450-460.
[3] Seagle E E, Williams S L, Chiller T M. Recent Trends in the Epidemiology of Fungal Infections[J]. Infect Dis Clin North Am, 2021, 35(2):237-260.
[4] Boroujeni Z B, Shamsaei S, Yarahmadi M, et al. Distribution of invasive fungal infections: Molecular epidemiology, etiology, clinical conditions, diagnosis and risk factors: A 3-year experience with 490 patients under intensive care[J]. Microb Pathog, 2021, 152:104616.
[5] Valentine J C, Morrissey C O, Tacey M A, et al. A population-based analysis of attributable hospitalisation costs of invasive fungal diseases in haematological malignancy patients using data linkage of state-wide registry and costing databases: 2009-2015[J]. Mycoses, 2020, 63(2):162-171.
[6] Gong Y, Li C, Wang C, et al. Epidemiology and Mortality-Associated Factors of Invasive Fungal Disease in Elderly Patients: A 20-Year Retrospective Study from Southern China[J]. Infect Drug Resist, 2020, 13:711-723.
[7] Firacative C. Invasive fungal disease in humans: are we aware of the real impact?[J]. Mem Inst Oswaldo Cruz, 2020, 115:e200430.
[8] Steinbrink J M, Miceli M H. Mucormycosis[J]. Infect Dis Clin North Am, 2021, 35(2):435-452.
[9] Reid G, Lynch J P, Fishbein M C, et al. Mucormycosis[J]. Semin Respir Crit Care Med, 2020, 41(1):99-114.
[10] Prakash h, Chakrabarti A. Global Epidemiology of Mucormycosis[J]. J Fungi (Basel), 2019, 5(1):26.
[11] Skiada A, Pavleas I, Drogari-Apiranthitou M. Epidemiology and Diagnosis of Mucormycosis: An Update[J]. J Fungi (Basel), 2020, 6(4):265.
[12] Mahalaxmi I, Jayaramayya K, Venkatesan D, et al. Mucormycosis: An opportunistic pathogen during COVID-19[J]. Environ Res, 2021, 201:111643.
[13] 中国医师协会血液科医师分会, 中国侵袭性真菌感染工作组. 血液病/恶性肿瘤患者侵袭性真菌病的诊断标准与治疗原则(第六次修订版)[J]. 中华内科杂志,2020,59 (10):754-763.
[14] Nucci M, Nouér S A, Cappone D, et al. Early diagnosis of invasive pulmonary aspergillosis in hematologic patients: an opportunity to improve the outcome[J]. Haematologica, 2013, 98(11):1657-1660.
[15] Alexander B D, Lamoth F, Heussel C P, et al. Guidance on Imaging for Invasive Pulmonary Aspergillosis and Mucormycosis: From the Imaging Working Group for the Revision and Update of the Consensus Definitions of Fungal Disease from the EORTC/MSGERC[J]. Clin Infect Dis, 2021, 72(Suppl 2):S79-S88.
[16] Caillot D, Couaillier J F, Bernard A , et al. Increasing volume and changing characteristics of invasive pulmonary aspergillosis on sequential thoracic computed tomography scans in patients with neutropenia[J]. J Clin Oncol, 2001, 19(1):253-259.
[17] Brodoefel H, Vogel M, Hebart H, et al. Long-term CT follow-up in 40 non-HIV immunocompromised patients with invasive pulmonary aspergillosis: kinetics of CT morphology and correlation with clinical findings and outcome[J]. AJR Am J Roentgenol, 2006, 187(2):404-413.
[18] 冷芸, 陈文明, 刘晋玮. 支气管肺泡灌洗液半乳甘露聚糖检测在诊断恶性血液病患者肺部真菌感染中的价值[J]. 中华血液学杂志, 2011, 32(8):551-552.
[19] 徐瑞娥,李凤珍,邵建平,等. COPD合并侵袭性肺曲霉菌病感染的诊断价值[J]. 疑难病杂志,2019,18(10):997-1001.
[20] 黄猛, 黎国喜, 陈天全. 支气管肺泡灌洗液1,3-β-D葡聚糖检测(G试验)、半乳甘露聚糖检测(GM试验)对早期诊断侵袭性肺部真菌感染的诊断价值[J]. 临床肺科杂志, 2019, 24(6):992-995.
[21] 《中华传染病杂志》编辑委员会. 中国宏基因组学第二代测序技术检测感染病原体的临床应用专家共识 [J] . 中华传染病杂志,2020,38 (11): 681-689.vSeo
[22] Seo H, Kim J Y, Son H J, et al. Diagnostic performance of real-time polymerase chain reaction assay on blood for invasive aspergillosis and mucormycosis[J]. Mycoses, 2021, 64(12):1554-1562.
[23] Marchiori E, Hochhegger B, Zanetti G. Importance of the reversed halo sign for diagnosis of mucormycosis[J]. Lancet Infect Dis, 2020, 20(5):538.
[24] Agrawal R, Yeldandi A, Savas H, et al. Pulmonary Mucormycosis: Risk Factors, Radiologic Findings, and Pathologic Correlation[J]. Radiographics, 2020, 40(3):656-666.
[25] Bourcier J, Heudes P-M, Morio F, et al. Prevalence of the reversed halo sign in neutropenic patients compared with non-neutropenic patients: Data from a single-centre study involving 27 patients with pulmonary mucormycosis (2003-2016)[J]. Mycoses, 2017, 60(8):526-533.
[26] 中华医学会检验医学分会临床微生物学组, 中华医学会微生物学与免疫学分会临床微生物学组, 中国医疗保健国际交流促进会临床微生物与感染分会. 宏基因组高通量测序技术应用于感染性疾病病原检测中国专家共识[J]. 中华检验医学杂志, 2021, 44(2):107-120.
[27] Patterson T F, Thompson G R, Denning D W, et al. Practice Guidelines for the Diagnosis and Management of Aspergillosis: 2016 Update by the Infectious Diseases Society of America[J]. Clin Infect Dis, 2016, 63(4):e1-e60.
[28] Herbrecht R, Maertens J, Baila L, et al. Caspofungin first-line therapy for invasive aspergillosis in allogeneic hematopoietic stem cell transplant patients: an European Organisation for Research and Treatment of Cancer study[J]. Bone Marrow Transplant, 2010, 45(7):1227-1233.
[29] Viscoli C, Herbrecht R, Akan H, et al. An EORTC Phase II study of caspofungin as first-line therapy of invasive aspergillosis in haematological patients[J]. J Antimicrob Chemother, 2009, 64(6):1274-1281.
[30] No authors listed. Correction to Lancet Infect Dis 2019; 19: 903-12[J]. Lancet Infect Dis, 2020, 20(4):e50.
[31] Ullmann A J, Aguado J M, Arikan-Akdagli S, et al. Diagnosis and management of Aspergillus diseases: executive summary of the 2017 ESCMID-ECMM-ERS guideline[J]. Clin Microbiol Infect, 2018, 24 Suppl 1:e1-e38.
[32] Tissot F, Agrawal S, Pagano L, et al. ECIL-6 guidelines for the treatment of invasive candidiasis, aspergillosis and mucormycosis in leukemia and hematopoietic stem cell transplant patients[J]. Haematologica, 2017, 102(3):433-444.
[33] Warris A, Lehrnbecher T, Roilides E, et al. ESCMID-ECMM guideline: diagnosis and management of invasive aspergillosis in neonates and children[J]. Clin Microbiol Infect, 2019, 25(9):1096-1113.
[34] 中国医师协会血液科医师分会, 中国侵袭性真菌感染工作组. 血液病/恶性肿瘤患者侵袭性真菌病的诊断标准与治疗原则(第六次修订版)[J]. 中华内科杂志, 2020, 59(10):754-763.
⭐ 作者介绍
雷伟教授
苏州大学附属第一医院呼吸与危重症医学科,医学博士,博士后,主任医师,副教授,硕士研究生导师
中国医师协会呼吸医师分会哮喘与变态反应工作委员会委员
中国老年医学学会呼吸病学分会哮喘学组委员
中国抗癌协会肿瘤介入专业委员会呼吸内镜分会青年委员
华东地区介入呼吸病协作组青年委员会委员兼秘书
江苏省医师协会呼吸医师分会肺功能与临床呼吸生理学组副组长
江苏省医学会呼吸病学分会青年委员会委员
江苏省医学会呼吸病学分会哮喘学组委员
苏州市变态反应学分会常委
苏州市医学会呼吸病学专业委员会青年委员
江苏省“科教强卫工程”青年医学人才,姑苏卫生人才
 后可发表评论
后可发表评论




友情链接
联系我们
 公众号
公众号
 客服微信
客服微信