登录方式
方式一:
PC端网页:www.rccrc.cn
输入账号密码登录,可将此网址收藏并保存密码方便下次登录
方式二:
手机端网页:www.rccrc.cn
输入账号密码登录,可将此网址添加至手机桌面并保存密码方便下次登录
方式三:
【重症肺言】微信公众号
输入账号密码登录
注:账号具有唯一性,即同一个账号不能在两个地方同时登录。
作者:刘学松
单位:呼吸疾病国家重点实验室 国家临床研究中心 广州医科大学附属第一医院 国家呼吸医学中心 广州呼吸健康研究院
机械通气作为危重症患者生命支持的关键技术,在挽救生命的同时,也面临呼吸机相关性肺损伤(VILI)的风险。肺不均一性及个体差异导致传统通气策略难以实现精准肺保护。电阻抗断层成像(EIT)技术通过实时监测肺部电阻抗变化,动态反映区域通气分布,为个体化通气管理提供了创新手段。本文系统阐述EIT的技术原理,分析其在肺复张评估、PEEP滴定、不同呼吸疾病中的应用价值,并与传统监测方法对比,探讨其在精准呼吸支持中的临床意义。
1. 机械通气的里程碑意义
机械通气在危重症救治中具有里程碑式的意义。回溯其发展历程,1952年脊髓灰质炎疫情中,首批31例因呼吸肌麻痹接受治疗的患者,在缺乏呼吸机支持的情况下,3天内死亡27例,死亡率高达87%。而到了1953年,随着呼吸机的应用,同类患者的死亡率显著降至15%。这一数据深刻体现了机械通气在挽救生命方面的关键作用。机械通气一方面可能引发呼吸机相关性肺损伤(VILI);另一方面,在合理使用的情况下,也能发挥肺保护作用。导致VILI的因素有多种:高气道压力可造成压力伤,大潮气量会引发容量伤,肺泡的反复开放与闭合可能导致剪切伤,细胞介导的肺部或全身炎症反应会形成生物伤,此外,机械能还可能带来能量伤。
2. VILI的流行病学与风险因素
研究显示,在因ARDS以外原因接受机械通气的患者中,高达24%会发生VILI。肺不均一性是VILI的重要诱因:通气正常区域、过度充气区域与塌陷区域在机械通气后呈现动态变化,气体分布失衡可加重肺损伤。
3. ARDS通气策略的争议
2017年JAMA杂志刊载的研究表明,针对中重度急性呼吸窘迫综合征(ARDS)患者,采用肺复张(RM)联合呼气末正压(PEEP)滴定(最大顺应性法),相较于低PEEP策略,会增加患者28天全因死亡率以及气压伤发生风险。受此影响,当前ARDS相关指南对常规开展肺复张已不再做推荐。这一调整的关键依据在于,不同ARDS患者的肺可复张性存在显著个体差异,气道压力需实施个体化设定。具体而言,可通过特定气道压力(5 cmH2O与45 cmH2O)下可充气肺组织比例,界定肺可复张性:当该比例≤9%时,判定为低可复张性患者;当比例>9%时,则为高可复张性患者。
2006年,Gattinoni教授团队借助CT研究发现,对低可复张性患者进行肺复张操作后,肺组织未实现有效开放,且影像学呈现心脏缩小表现,间接提示心输出量下降;而对于存在弥漫性病变的高可复张性患者,肺复张能够使部分塌陷肺组织重新复张。
ARDS患者肺部损伤并非局限单一区域,常存在肺泡通气相关损伤。如图1复张前背侧肺气体含量极少。理想状态下,复张后腹侧与背侧肺应实现均衡通气,可实际是原本扩张的肺区进一步过度扩张,造成肺内气体分布紊乱。基于此,依据ARDS患者影像学分型等精准采取通气策略,对改善预后意义重大。临床需重视个体化评估不同肺区通气状态,挖掘常规监测易忽略的区域肺现象(如肺泡过度膨胀、周期性开闭、局部肺不张等),让呼吸治疗更精准。
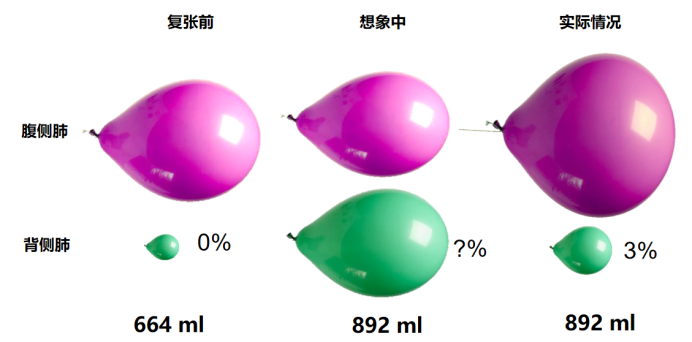
图1 ARDS患者复张前后的理想与实际情况
不同肺区域对通气的需求存在差异。在PEEP升高与降低的过程中,患者的吸气压会随之改变。因此,在实施肺复张操作前,需先开展肺复张评估。临床中,可借助多种手段评估,比如监测肺顺应性、观察氧合指标等方法,判断患者对肺复张操作的反应,区分“有反应者(肺复张后通气改善)”与“无反应者(肺复张效果不佳)”,为后续精准通气策略制定提供依据。
1. 技术原理
EIT的原理是以人体内部的生物电阻率分布为目标重建体内组织图象。胸部EIT成像已经排除了心脏、血流等电阻抗的影响,反映肺局部通气情况。与其他组织不同,肺组织的生物导电性会因含气量改变而变化较大。吸气末时,肺内气体增多,电阻较呼气末显著升高,可达300%,且呈潮汐性波动。EIT技术可实现个体化区域肺通气监测,其利用通气过程中,电极平面内肺部电阻抗值的改变,实时呈现气体分布情况与呼气末肺容积的动态变化。EIT的敏感区(即电极平面)与绑带位置相关,推荐固定于第4~5肋间,在此位置可监测到20%~30%的肺内通气变化。每张EIT图像由16个电极产生的208个电压信号构成,成像速度可达每秒10~50张,能够对肺通气进行动态监测。当前,EIT主要有2D成像和3D成像两种模式,可满足不同临床场景的监测需求。
2. EIT与CT的互补性
CT和EIT在应用中各具优缺点,但也有一定的互补性(表1,图2,视频1)。
表1 胸部CT与EIT优缺点比较
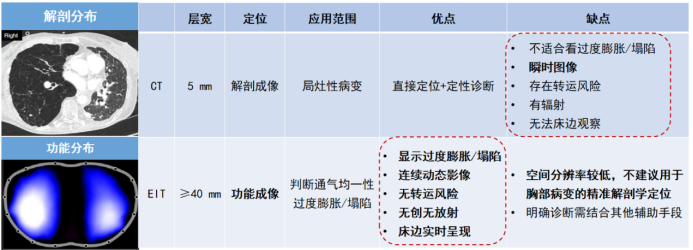
图2 CT解剖成像显示含气组织
视频1 EIT功能性呈像:显示气体进出变化的区域
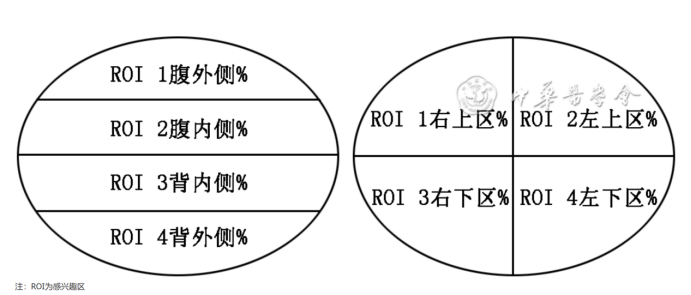
EIT通过不同分区方式可将肺部分为多个感兴趣区(ROI): 一种是纵向划分, 包括ROI 1腹外侧、ROI 2腹内侧、ROI 3背内侧和ROI 4背外侧; 另一种是象限划分, 包含ROI 1右上区、ROI 2左上区、ROI 3右下区和ROI 4左下区。
3. EIT的各种参数和曲线
参数:低位像素带(LPB),高位像素带(HPB),呼气末肺阻抗(EELI),呼气末肺阻抗(EILI),感兴趣区(ROI),切点频率。
曲线:全局肺通气阻抗曲线,区域肺通气阻抗曲线,全局肺灌注阻抗曲线。
PEEP滴定曲线:过度膨胀/顺应性(OD/CL),全局不均一指数(GI),EELI,区域通气延迟(RVD),EIT时间常数(τ-EIT),低/高(L/H)。
图像:胸部阻抗肺通气断层成像(动态成像、状态成像、ΔEELI),胸部阻抗肺灌注断层成像(动态成像与状态成像),PEEP滴定视图,趋势视图。
1. EIT评估肺可复张性和指导PEEP滴定
EIT技术能够在自主呼吸试验(SBT)期间,对潮气量的空间分布进行可视化呈现与定量化分析。GI升高或EELV下降(提示肺塌陷发生)时,可作为预测SBT失败的指标。如图3所示,在实施肺复张操作前后,肺部通气状况呈现出显著差异,借助EIT可清晰捕捉并直观展现这种变化,为评估肺复张效果、指导呼吸治疗提供有力依据。
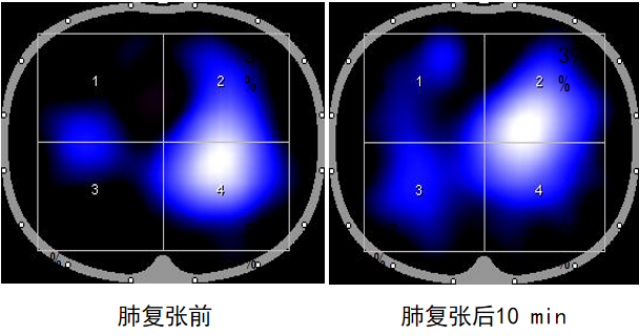
图3 肺复张前后肺部通气的分布情况
评估肺的可复张性,可通过对比两个不同时间点潮气图像的阻抗差值实现。将差值以图像形式呈现(差值图像)(图4),能够精准判别肺内通气阻抗变化的部位,明确是哪些区域的阻抗增加(提示通气改善等可能),又或是哪些区域的阻抗减少(可能存在肺塌陷等情况),从而为判断肺复张效果、分析肺通气功能状态提供直观的依据。
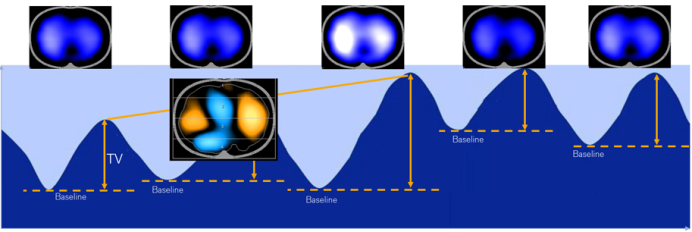
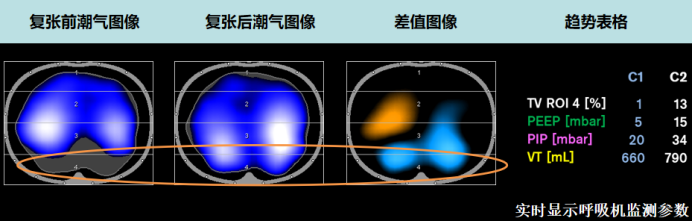
图4 阻抗差值图像
肺可复张性评估参考流程如下:①设置ROI:采用分层模式,将肺部分为腹侧与背侧区域;②实施肺复张并对比分析:在实施肺复张操作后,对比复张前与复张过程中的肺通气分布状态,核心评估指标为通气分布的均一性是否改善;③判定可复张患者:对于背侧区域(ROI 4)的通气量较复张前出现明显增加的患者,可判定为具备可复张性的患者。图5-7所示为经EIT评估的肺可复张性。
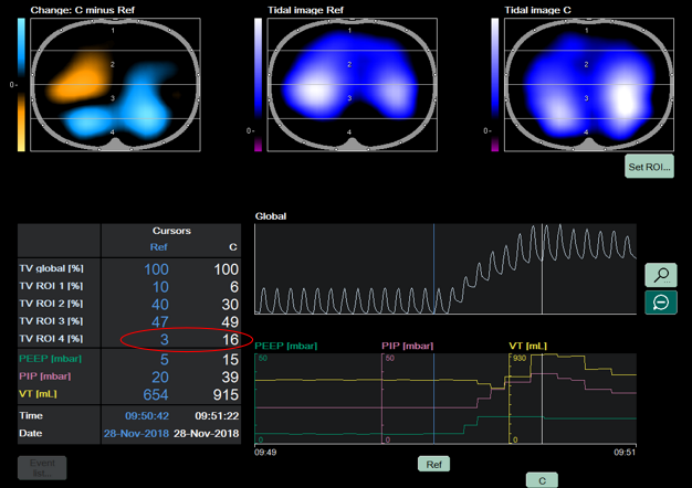
图5 有可复张性
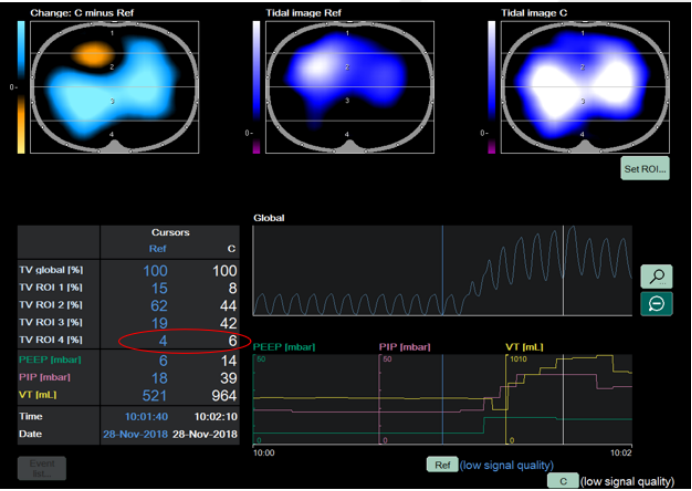
图6 部分可复张性
图7 无可复张性
在ARDS等呼吸疾病的机械通气管理中,基于过度膨胀与塌陷(OD/CL)平衡的PEEP选择是优化肺保护通气的关键策略。若重点关注肺塌陷,需筛选满足“塌陷率≤10%或≤15%”条件,且过度膨胀率最低的PEEP水平,让塌陷肺泡复张同时减少过度膨胀风险;若更在意过度膨胀,可将“过度膨胀率≤10%”作为目标确定PEEP;也可直接选取塌陷与过度膨胀曲线交点对应的PEEP,此点PEEP常与略微增加(约+2 cmH2O)相契合,实现二者的临床平衡,为个性化呼吸支持提供依据(图8)。
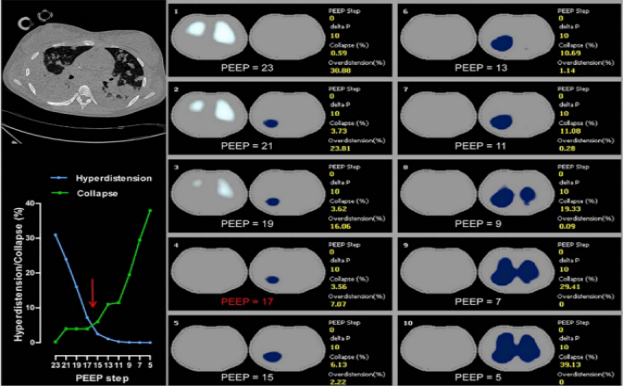
图8 基于过度膨胀与塌陷(OD/CL)的PEEP选择
2022年《中华医学杂志》发表了《肺电阻抗成像技术在重症呼吸管理中的临床应用中国专家共识》,推荐EIT指导ARDS患者个体化PEEP滴定有助于更好地实施肺保护,可能有助于改善ARDS患者预后。
2. EIT在特殊人群中的应用
图9是一名接受有创机械通气单侧左肺炎患者的EIT PV曲线。A图显示单侧左肺炎患者左右两肺EIT得出的PV曲线。该图显示了左肺的气道开放压(AOP),在同时分析两个肺时无法捕捉到该压力。B图显示PEEP为5 cmH2O(即低于左肺的气道开放压)时,左肺的潮气通气量仅占总潮气通气量的10%,PaO2/FiO2为173 mmHg。C图显示PEEP为14 cmH2O(即高于左肺的AOP)时,左肺的潮气通气量增加到总潮气通气量的20%,PaO2/FiO2达到245 mmHg。
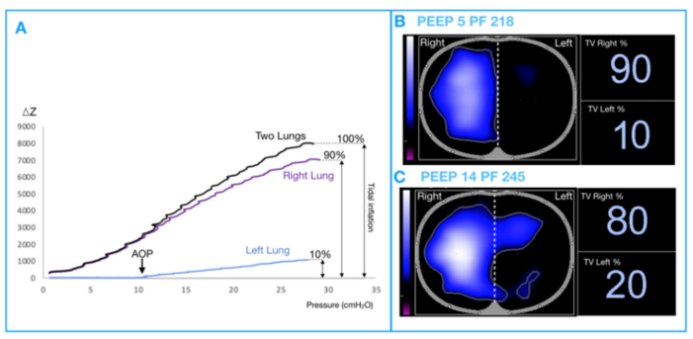
图9 有创机械通气的单侧左肺炎患者EIT-PV曲线
图10为肥胖志愿者(BMI=35 kg/m2,左)和体重正常志愿者(BMI= 21 kg/m2,右)EIT肺通气图像对比,肥胖可导致EIT肺通气图像呈“左右肺融合单一类圆型轮廓”,但不影响EIT连续动态的肺通气监测。
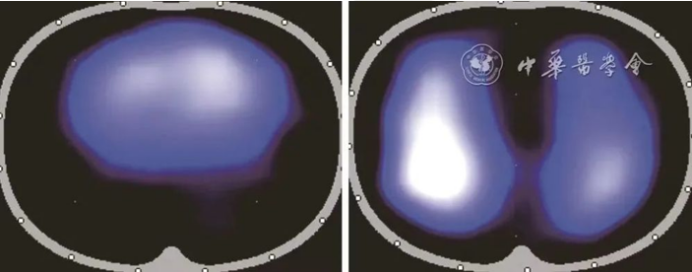
图10 肥胖志愿者与体重正常志愿者EIT肺通气图像对比
3. 临床监测
(1)气胸:能够识别低至20 ml的气胸区域,且敏感性高(图11)。

图11 EIT识别气胸
(2)通气缺损:实时监测单侧肺炎或肺栓塞导致的区域通气下降(图12)。
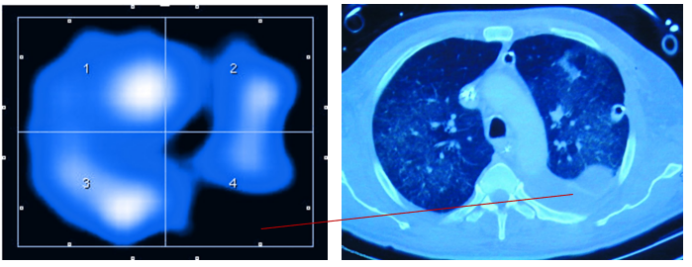
图11 EIT识别通气缺损
(3)肺大血管栓塞:如果血流缺损,通气也会产生变化,可以据此推断肺血管栓塞可能。
视频2 EIT辅助肺大血管栓塞的诊断和治疗评估
(4)肺肿瘤切除术后监测:如图12所示,胸片虽显示肺外观结构未严重毁损,仍有部分肺组织显影,但结合EIT影像可见,部分肺区通气功能近乎丧失,通气功能异常会直接导致氧合水平下降,且随着病情的进展,肺通气障碍若持续加重,氧合恶化将更加显著。通过EIT监测及时发现这类通气异常,并给予针对性干预,可促进肺复张,恢复有效通气。
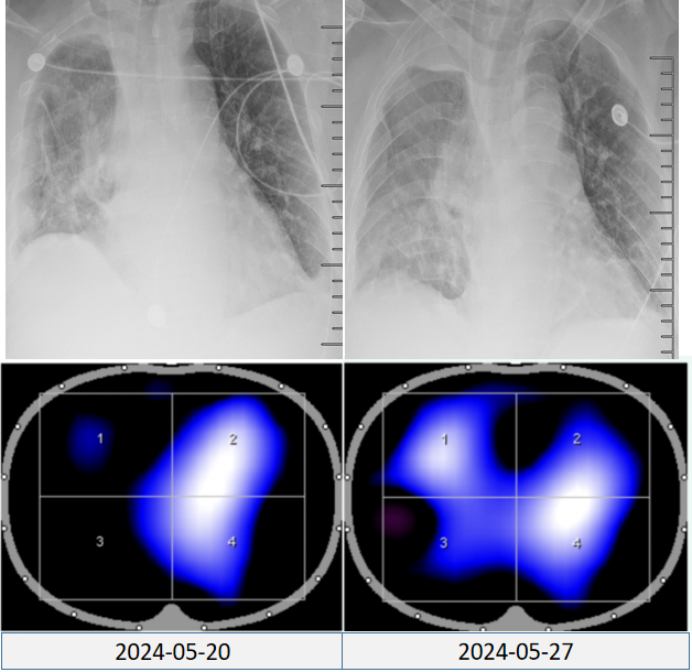
图12 EIT用于肺肿瘤切除术后监测
(5)俯卧位通气监测:俯卧位通气在临床中备受关注且展现出显著效果,借助EIT技术可以清晰阐释其作用机制:随着俯卧位通气时间的延长,EIT监测显示肺内气体分布逐渐趋于均匀,同时血流灌注也得到改善(图13)。当气体分布与血流灌注二者协同优化,通气血流比值(V/Q)愈发匹配,呼吸功能随之改善。EIT能够实时、精准捕捉肺内通气与血流的动态变化。
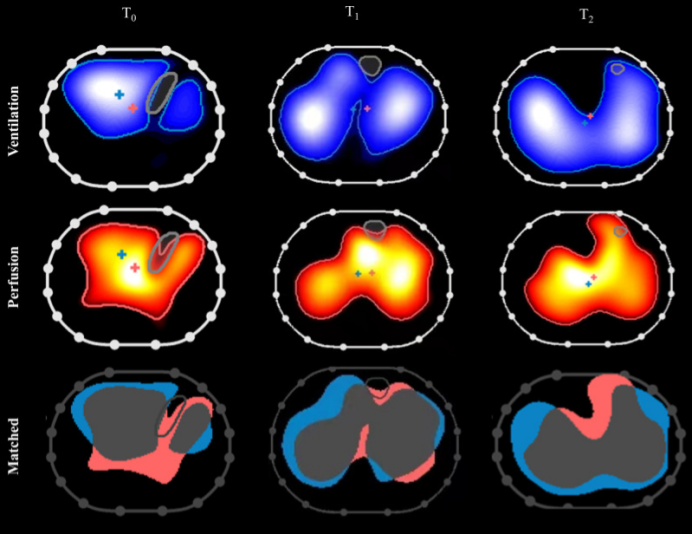
图13 俯卧位对患者通气-灌注匹配的影响
图源:Crit Care, 2022, 26(1):154.
1. EIT在COPD中的应用
合并慢性阻塞性肺疾病(COPD)的ARDS患者,其肺内病理改变的不均一性及气体分布特点更为复杂。在机械通气中应用PEEP时,此类患者面临肺容积过度增加、肺泡过度膨胀及心功能受抑制的风险,而肺泡过度膨胀也是导致VILI的重要诱因。因此,合并COPD的ARDS患者应用PEEP的潜在不良风险相对更高,其通气策略(尤其是PEEP的选择)目前尚未明确。研究表明,与不合并COPD的ARDS患者相比,合并COPD的ARDS患者所需滴定的PEEP水平更低。具体而言,在合并COPD的ARDS患者中,采用EIT技术滴定的PEEP水平低于依据ARDSNet方案设定的PEEP水平。这一策略有助于改善通气比例、降低机械能消耗、提高心脏指数及氧输送效率,同时对血流动力学的不利影响更小。
EIT在COPD治疗中具有多元应用价值:①评估内源性呼气末正压(PEEPi):可动态呈现不同临床场景下COPD患者的通气与肺容积信息,助力医生精准补充适度的外源性PEEP,降低VILI发生风险;②分析不同体位对肺通气的影响:借助EIT实时监测肺部气体分布,为医生筛选优化氧合的通气体位提供依据,指导体位干预改善呼吸功能;③指导高流量鼻导管氧疗(HFNC):一方面,通过EIT观察HFNC对EELI的作用;另一方面,可追踪HFNC对非重力依赖区通气及氧合的改善效果,优化该治疗手段的应用;④评价肺康复疗效:能以床旁监测形式直观反馈物理治疗等肺康复措施对COPD患者肺部通气状态的改善情况,辅助康复方案调整。
2. EIT指导ECMO患者机械通气设置
研究显示,重度ARDS接受ECMO患者的理想PEEP存在异质性,EIT可作为评价这些患者PEEP效应的床旁无创监测工具。进行ECMO治疗的重度ARDS患者的最佳PEEP存在广泛差异,更需要个体化PEEP滴定等呼吸治疗设置。
3. 肺灌注评估
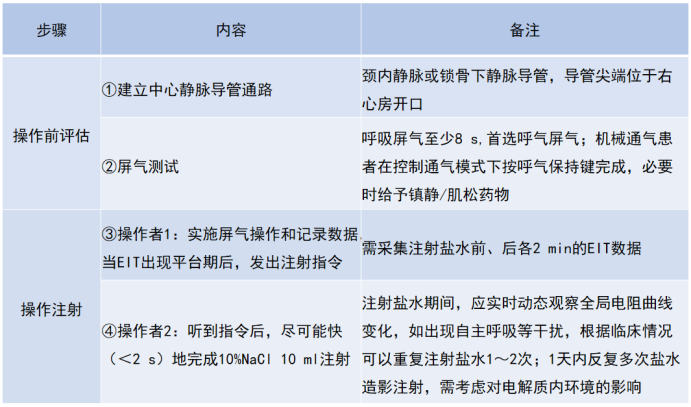
在肺灌注评估中,经典方法是推注高渗盐水。高渗盐水经肺循环(右心→肺动脉→肺静脉→左心)时,遵循首过原理产生特征性稀释波形。当高渗盐水流经肺内区域,会使该区域电阻抗下降,电阻抗下降越显著,提示对应区域血流灌注越丰富;反之,灌注相对较少。借助分析不同肺区的电阻抗波形变化,可定量评估区域肺灌注状态,为判断肺血流分布、识别灌注异常区提供精准数据。具体操作流程见表2。
表2 利用EIT进行肺灌注评估的操作流程
EIT操作关键参数与注意事项:
(1)电极带定位(2D模式):水平位需贴合锁骨中线4~6肋间,确保电极与皮肤直接接触,保障信号采集的稳定性。
(2)扫描层厚(2D模式):以电极带为中心,上下各延伸5 cm范围(覆盖约50%肺脏区域),呈现平均断层扫描结果,反映该层面肺功能信息。
(3)信号质量与监测区域:信号质量从低到高变化时,低位像素带(LPB)监测不受干扰;但高位像素带(HPB)监测需信号质量为“高”才具备准确性,建议HPB监测时配合使用电极膏,优化信号传导。
(4)切点频率设置:默认设定为55次/min,需依据患者的心率动态调节。若心率<3倍呼吸频率,HPB监测易出现图像失真、数据不准确,需特别关注参数适配性。
(5)图像稳定时间:机器启动后,通气图像约30 s趋于稳定;血流图像受电极带信号质量、患者自身状态(如循环动力学)影响更大,存在延迟性,临床曾出现等待5 min才获得稳定血流图像的情况,操作中需预留充足的观察时间。
(6)信号干扰规避:HPB信号易被心电监护仪的呼吸频率监测功能干扰,建议关闭该监护功能或移除心电电极贴片,保证EIT血流信号采集的纯净度。
EIT作为精准呼吸监测工具,聚焦众多临床热点。在呼吸治疗中,可辅助实现肺复张/PEEP滴定,借压力-容积曲线优化通气;支持自主呼吸监测,助力脱机预测;用于肺灌注评估,结合高渗盐水注射洞察血流;还覆盖俯卧位通气效果追踪、高流量氧疗响应分析,以及与ECMO、气道压力释放通气(APRV)等特殊呼吸支持手段的协同应用。从跨肺压研究到气体摆动、神经调节辅助通气等可变压力支持场景,EIT持续为ARDS等重症呼吸管理提供创新视角,推动个性化呼吸治疗迈向精准化。
EIT作为一种无创、实时的功能成像技术,突破了传统监测的局限,为机械通气的精准化管理提供了“可视化”工具。通过动态评估区域通气分布,指导肺复张与PEEP滴定,EIT有望降低VILI风险,改善危重症患者预后。未来需进一步探索其在复杂临床场景中的应用,推动呼吸支持技术从经验医学向精准医学跨越。
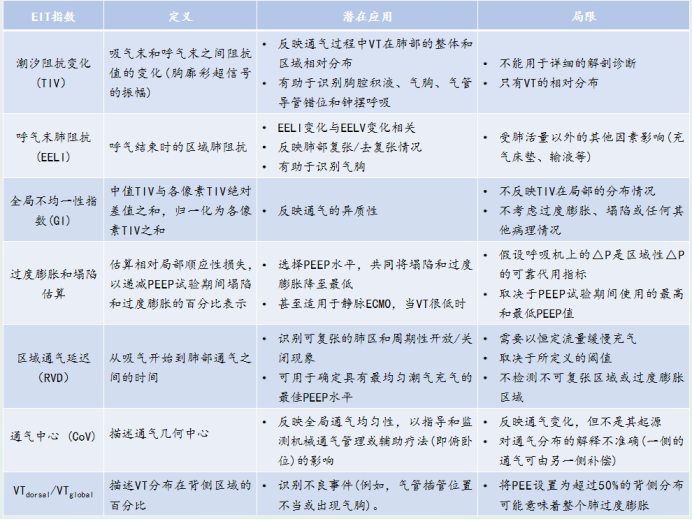
附表 呼吸衰竭低氧血症患者最常用的EIT指数的定义、临床应用和局限性
作者介绍

刘学松
广州医科大学附属第一医院 广州呼吸健康研究院 国家呼吸医学中心 重症医学科病区主任,博士,副主任医师,硕士生导师;中国老年医学学会呼吸病学分会委员,中国心胸血管麻醉协会体外生命支持分会委员,中国医师协会体外生命支持专业委员会青年委员,中国医师协会呼吸医师分会危重症青年委员,广东省医学会重症医学分会委员,广东省器官医学与技术学会重症专委常务委员,广东省医院协会重症医学管理分会常务委员,广州市康复医学会重症康复分会副主任委员,广州市临床用药质控中心临床专家组副组长,广州市医学会重症医学分会委员,广东省医师协会呼吸医师分会呼吸治疗专业委员会常委,广东省医院协会医院重症监护中心管理专业委员会青年委员,广东省药学会重症医学用药委员会委员,广东省呼吸康复专业委员会委员,广东省健康管理学会重症医学专业委员。
本文仅用于学术内容的探讨和交流,不用于任何商业和推广,亦不作为最终的临床决策。临床实践需根据患者的具体情况选择适宜的处理措施。
 后可发表评论
后可发表评论




友情链接
联系我们
 公众号
公众号
 客服微信
客服微信