登录方式
方式一:
PC端网页:www.rccrc.cn
输入账号密码登录,可将此网址收藏并保存密码方便下次登录
方式二:
手机端网页:www.rccrc.cn
输入账号密码登录,可将此网址添加至手机桌面并保存密码方便下次登录
方式三:
【重症肺言】微信公众号
输入账号密码登录
注:账号具有唯一性,即同一个账号不能在两个地方同时登录。
本文来源:协和医学杂志公众号
通信作者:卓超1,徐英春2,俞云松3
作者单位:1广州医科大学附属第一医院检验科,2中国医学科学院北京协和医院检验科,3浙江省人民医院检验科
项目基金:国家科技重大专项-四大慢病(2024ZD0532800)
文章拟发表于《协和医学杂志》2025年第5期
肠杆菌目细菌是临床常见的重要病原菌,可导致多种感染性疾病,如下呼吸道感染、血流感染、泌尿系统感染及腹腔感染等。β-内酰胺类抗菌药物是治疗此类感染的核心药物,主要包括青霉素类、头孢菌素类、单环β-内酰胺类、 β-内酰胺类/酶抑制剂复方制剂、碳青霉烯类。然而,随着此类药物的广泛使用,产超广谱β-内酰胺酶(ESBL)肠杆菌目细菌(ESBL-E)的检出率越来越高,导致临床耐药形势日益严峻,已成为全球公共卫生一大挑战。ESBL-E普遍呈现多重耐药表型,在世界卫生组织最新发布的《2024年细菌类重点病原体目录》中,ESBL-E被列为“关键优先组”病原体,且排名升至第2位[1]。
根据全国细菌耐药监测网(CARSS)(https://www.carss.cn/)2021—2024年监测数据,产ESBL仍是我国革兰阴性菌最主要的耐药机制,有效治疗和防控ESBL-E感染,不仅能够降低其发病率和相关病死率,对改善革兰阴性菌耐药环境亦可起到积极作用,同时也能间接遏制碳青霉烯类耐药菌(CRO)的传播与流行。
ESBL不仅可通过质粒介导在菌种间水平传播,还能通过基因捕获、整合或突变获得其他耐药基因,导致ESBL-E呈现多重耐药表型。除对β-内酰胺类抗菌药物耐药外,ESBL-E还可对其他多种抗菌药物(氨基糖苷类、喹诺酮类、磺胺类、四环素类、硝基呋喃类)产生交叉耐药。监测数据显示,我国检出的CRO菌株中,多数菌株同时携带ESBL基因。因此,加强ESBL-E的防控是遏制CRO传播的基础。通过“关口前移”这一策略,可解决我国革兰阴性菌耐药的两大难题(即产ESBL和碳青霉烯酶),助力遏制病原微生物耐药国家行动计划的实施。
本共识在2014版基础上,更新了ESBL-E的流行病学特征、实验室检测方法、不同感染类型和部位(包括血流感染、颅内感染、呼吸系统及胸腔纵隔感染、腹腔感染、泌尿系统感染)的临床治疗以及感染管理等方面内容,尤其新增了针对特殊人群(包括中性粒细胞缺乏伴发热患者、急诊患者及儿童患者)的诊断与治疗策略,以期为临床医生提供可借鉴的指导意见。
1

共识制订方法
本共识专家组由感染病学、呼吸与危重症医学、急诊医学、血液病学、儿科学、医学检验微生物学和医院感染管理等多学科领域专家组成。编写组于2024年4月组建并召开编写会议,拟定共识关键问题和提纲。
中文检索词包括“超广谱β-内酰胺酶”“产超广谱β-内酰胺酶肠杆菌目细菌”“抗菌药物” “目标治疗”“分层治疗”“专家共识”;英文检索词包括 “ESBLs”“ESBLs-producing Enterobacterales”“Antimicrobial agents” “Targeted therapy”“Stratified treatment”“Expert consensus”;在PubMed、Embase、Cochrane Library、中国知网、万方数据知识服务平台、维普网检索相关报道及文献,检索时限为数据库建库至2024年12月。
排除标准:①重复发表的文献;②非中、英文文献;③无法获取全文。通过初步检索,共获取相关文献80篇,根据纳入和排除标准,最终纳入文献50篇。
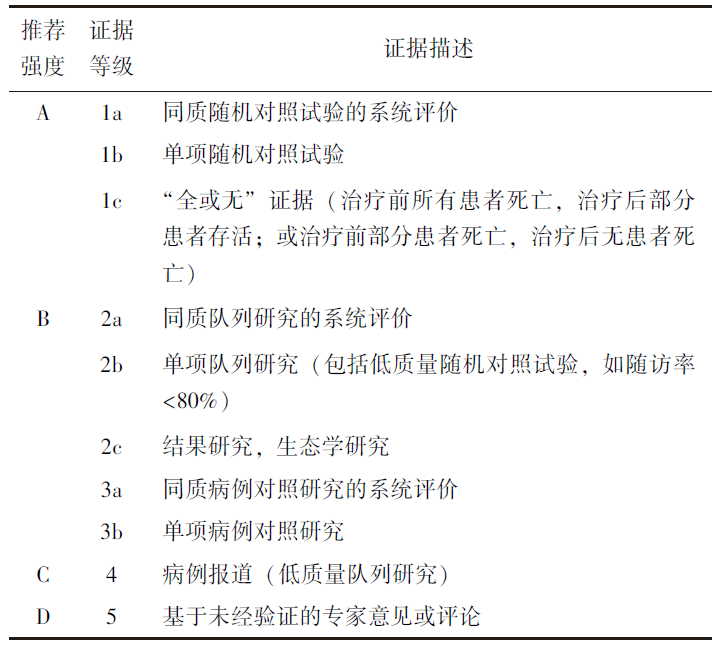
本共识证据等级和推荐强度参考 2001年牛津循证医学中心制定的推荐强度和证据等级分类(表1),结合我国ESBL-E感染的流行病学特征及临床工作经验,经多次讨论和反复修订形成共识草案及10条推荐意见。2025年4月,通过德尔菲法向57名相关学科专家组成的编审专家组征求意见,57名专家均对推荐意见进行了评分。计算每条推荐意见的平均分,1~4分为“不推荐”,5~7 分为“弱推荐”,8~10分为“强推荐”。共收到专家意见10条,编写组逐条讨论确认和修订,结合推荐意见评分,经修订后形成共识终稿。
表1 2001年牛津循证医学中心推荐强度和证据等级分类
2

ESBL-E流行病学特征
肠杆菌目细菌可导致临床多种感染性疾病的发生,三代头孢菌素类是治疗感染的重要抗菌药物,然而,产ESBL已成为该菌群对三代头孢菌素类耐药的主要机制[2]。流行病学研究显示,大部分革兰阴性菌可携带ESBL编码基因,尤以大肠埃希菌、肺炎克雷伯菌、产酸克雷伯菌和奇异变形杆菌最为常见[3]。鉴于美国临床和实验室标准协会(CLSI)已取消ESBL的常规检测要求,临床中现多通过头孢曲松或头孢噻肟(ESBL的最佳水解底物)的耐药率间接评估ESBL的阳性率[4]。该耐药机制自20世纪80年代首次报道以来,已呈现全球广泛流行趋势,整体检出率上升且存在地区差异[3,5]。SENTRY监测数据显示,ESBL-E的检出率从1997—2000年的10.3%显著攀升至2013—2016年的24.0%,区域分布显示拉丁美洲增幅最大(22.4%),其次是亚太地区(17.6%)、欧洲(16.2%)及美国(10.9%)[5]。SMART(Study for Monitoring Antimicrobial Resistance Trends)全球监测数据进一步表明,2015—2019年间亚洲地区(中国除外)产ESBL大肠埃希菌的检出率已突破50%[6],提示该耐药现象在特定区域的严峻态势。
2024年中国细菌耐药监测网(CHINET)最新结果显示,肠杆菌目细菌对头孢噻肟的耐药率存在显著种间差异:大肠埃希菌(52.9%)>肺炎克雷伯菌(41.8%)>奇异变形杆菌(38.6%)。2023年CARSS最新数据显示,大肠埃希菌与肺炎克雷伯菌对三代头孢菌素的耐药率分别为48.9%和27.7%,较既往数据均呈下降趋势。值得注意的是,近年来儿童群体中产ESBL沙门氏菌的检出率较高,且呈上升趋势。CHINET监测数据显示,儿童群体中产ESBL沙门氏菌(伤寒和副伤寒A~C血清型除外)对头孢曲松的耐药率从2015年的15.8%攀升至2021年的23.1%[7],提示儿科抗感染治疗面临挑战。
ESBL-E的分布具有明显的病房特异性。一项中国地区的5年回顾性研究(n=4928,含大肠埃希菌2154株、肺炎克雷伯菌2774株)显示,产ESBL大肠埃希菌为723株,产ESBL肺炎克雷伯菌为399株。其中两种细菌产ESBL的检出率在不同病房来源的样本中存在显著差异(P<0.05),详见图1[8]。
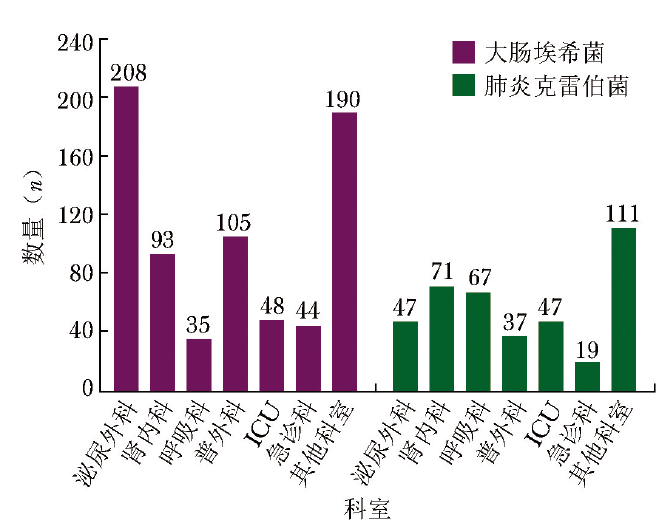
图1 不同病房来源的样本中ESBL-E菌株分布情况[8]
注:ESBL-E:产超广谱β-内酰胺酶肠杆菌目细菌;ICU:重症监护病房。
目前已鉴定的ESBL酶型主要包括以下类别:
1
主要流行型别:CTX-M(>200余种)、SHV(>40余种)、TEM(>80余种)和OXA;
2
少见型别:GES、PER、SFO、VEB、TLA等[9]。
其流行谱系具有一定的时代演变特征,20世纪以TEM型和SHV型为主,而21世纪以来CTX-M型成为主要流行型别[9-10]。全球监测数据显示,CTX-M在大肠埃希菌和肺炎克雷伯菌中的检出率分别高达87.4%和86.7%[11]。
目前,CTX-M的亚型分布具有以下特点:
1
在全球范围内主要以CTX-M-15最为常见,其次是CTX-M-14,但近年来CTX-M-27、CTX-M-55逐渐成为新兴亚型[9,11-12]。
2
存在地域差异,美国以CTX-M-15为主[13],而我国以CTX-M-14为主,CTX-M-15次之[14]。
ESBL-E的全球广泛流行与以下机制密切相关:
首先,其编码基因主要位于质粒,便于水平转移;其次,其可通过高危克隆传播,包括携带blaCTX-M-15的ST131、ST410型大肠埃希菌和携带blaCTX-M-15的ST147、ST307、ST395型肺炎克雷伯菌等。此类传播特性对临床感染防控构成严峻挑战,需引起高度重视[9,15]。
CTX-M型ESBL对不同β-内酰胺类药物的水解活性存在亚型差异,如CTX-M-14、CTX-M-3及CTX-M-65对头孢噻肟和头孢曲松的水解能力优于头孢他啶;CTX-M-15、CTX-M-27、CTX-M-55及CTX-M-64则对头孢他啶表现出更强的水解活性。CTX-M-190甚至对β-内酰胺酶抑制剂(他唑巴坦和舒巴坦)具有耐受性[16]。研究发现,肺炎克雷伯菌可通过两种途径(一是质粒重组与染色体整合提供额外的启动子,二是blaSHV-12基因串联拷贝数增加)使blaSHV-12基因表达水平上调,导致其对新型复方制剂(头孢他啶-阿维巴坦)耐药。携带ESBL基因的菌株常合并AmpC酶或碳青霉烯酶共表达、外膜蛋白(OMPs)缺失,从而形成多重耐药表型,导致临床治疗难度升级[17]。
3

ESBL-E实验室检测
ESBL的实验室检测方法主要包括表型检测和基因检测。
1
表型检测:标准方法常采用CLSI和欧洲抗菌药物敏感性试验委员会(EUCAST)推荐的酶抑制剂增强试验(如纸片扩散法、E-test法和肉汤微量稀释法),辅助方法包括生物化学比色法、免疫层析技术以及基质辅助激光解吸飞行时间质谱仪(MALDI-TOF MS)分析;
2
基因型检测:包括PCR、DNA微阵列技术、全基因组测序等,需结合基因突变位点分析以确认ESBL产生的可能性。
对于有条件的实验室,建议对ESBL进行检测并报告。对于经确证的ESBL阳性菌株(ESBL-E),应报告该菌株对所有青霉素类、头孢菌素类和氨曲南耐药。虽然体外药敏试验显示,ESBL-E对部分头孢菌素类及氨曲南敏感,但其临床疗效目前尚缺乏足够的临床证据,需结合最小抑菌浓度(MIC)及病情严重程度综合评估。为加强感染治疗与防控,建议在药敏试验报告中对ESBL阳性菌株进行备注说明。
4

ESBL-E感染的治疗
ESBL-E感染的危险因素包括:
1
医疗环境暴露:包括反复住院、血液透析治疗、门诊伤口/导管护理等医疗机构接触史,以及宿主易感性[如年龄>65岁、合并基础疾病(糖尿病、免疫功能低下)];
2
细菌定植情况:既往定植/感染史(过去6个月内曾有ESBL-E感染或定植)以及持续定植高危群体(免疫功能低下者);
3
抗菌药物选择压力:主要指长期(超过7~14 d)或频繁使用(数月内多次用药)广谱抗菌药物(特别是头孢菌素和喹诺酮类药物)治疗;
4
侵入性操作与解剖异常:侵入性操作如中心静脉导管留置、机械通气、呼吸机辅助通气等,解剖异常包括泌尿系统/胆道梗阻等。
在制订抗感染治疗方案时,患者病情严重程度是关键决策因素之一。然而,目前临床对重症感染的界定尚未完全统一。以下标准可作为重症感染诊断的参考:
1
由感染引起的脓毒症和脓毒性休克可视为重症感染,即发生机体对感染反应失调而导致的危及生命的器官功能障碍(脓毒症),或在脓毒症基础上合并严重的循环、细胞和代谢异常(脓毒症休克)。按照脓毒症3.0定义,感染后序贯器官衰竭评估(SOFA)评分快速增加≥2分可诊断为脓毒症,快速SOFA评分(qSOFA)≥2分为疑似脓毒症;脓毒症患者经充分容量复苏后仍存在持续性低血压,需缩血管药物维持平均动脉压≥65 mm Hg(1 mm Hg=0.133 kPa)且血乳酸水平>2 mmol/L,诊断为脓毒症休克。对于儿童患者,则采用菲尼克斯脓毒症评分(PSS),感染合并PSS≥2分可诊断为脓毒症;脓毒症合并心血管功能障碍(PSS≥2分及心血管系统功能评分≥1分),可诊断为脓毒症休克。
2
特殊部位感染如中枢神经系统感染、血流感染常按重症感染标准处置。
3
免疫功能低下患者(如中性粒细胞缺乏),合并感染时极易进展为重症感染,需引起高度重视。
对于ESBL-E的治疗,应综合感染部位、感染严重程度、药物的组织浓集性、药物剂型、药效学和药代动力学(时间依赖性还是浓度依赖性)、药物毒性、耐药性、患者免疫状态等情况,综合选择适宜的抗菌药物治疗。[证据等级:2a;推荐强度:B]
轻中度感染,推荐应用β-内酰胺类/酶抑制剂复方制剂、头霉素类、氧头孢烯类治疗体外敏感菌;重症感染或血流感染,推荐应用碳青霉烯类药物;CRO 可考虑应用多黏菌素治疗。[证据等级:1b;推荐强度:A]
针对ESBL-E感染的抗菌药物选择需综合考虑患者感染的严重程度、病原菌体外药敏试验结果及药物特性。
4.3.1 碳青霉烯类
碳青霉烯类是治疗ESBL-E感染的首选药物,尤其适用于重症感染、血流感染及中枢神经系统感染。美罗培南因其低耐药诱导特性及良好的血脑屏障穿透能力,可优先选用,必要时可调整剂量或延长输注时间。品种主要包括:美罗培南、亚胺培南、比阿培南和厄他培南等。
4.3.2 β-内酰胺类/酶抑制剂复方制剂
产ESBL大肠埃希菌和肺炎克雷伯菌株对不同的复方制剂敏感性存在较大差异,对阿莫西林/克拉维酸、氨苄西林/舒巴坦和替卡西林/克拉维酸的敏感率低。对于敏感菌株所致下尿路感染,部分患者可口服阿莫西林/克拉维酸。头孢哌酮/舒巴坦和哌拉西林/他唑巴坦对部分ESBL-E菌株有效(敏感率60%~80%),主要适用于轻中度感染,同时应优化给药方案(如增加剂量与次数、延长输注时间)。新型β-内酰胺类/酶抑制剂复方制剂,如亚胺培南/瑞来巴坦、美罗培南/韦博巴坦、头孢他啶/阿维巴坦等,对ESBL-E有抗菌活性,但不建议临床常规用于ESBL-E感染的治疗。
4.3.3 头霉素类
头霉素类药物对ESBL-E稳定。对产ESBL大肠埃希菌和肺炎克雷伯菌保持较好的体外抗菌活性,但临床耐药率显著高于碳青霉烯类(美罗培南、亚胺培南等)、β-内酰胺类/酶抑制剂复合制剂(头孢哌酮/舒巴坦、哌拉西林/他唑巴坦)。头霉素类推荐用于治疗ESBL-E所致的轻中度感染,尤其适合ESBL-E感染的降阶梯治疗。常用药物包括头孢西丁、头孢美唑、头孢米诺和头孢替坦。
4.3.4 氧头孢烯类
氧头孢烯类药物对ESBL-E稳定。体外药敏试验显示,该类药物对产ESBL大肠埃希菌和肺炎克雷伯菌表现出较高的敏感性。其体内抗菌活性低于碳青霉烯类及β-内酰胺类/酶抑制剂复方制剂。目前,临床用于治疗ESBL-E感染的循证医学证据有限,主要推荐用于以下两种情况:(1)ESBL-E所致的轻度感染;(2)ESBL-E感染的降阶梯治疗。需注意的是,使用时应严格参照体外药敏试验结果,并密切监测临床疗效。常用药物包括拉氧头孢和氟氧头孢。
4.3.5 氟喹诺酮类
除西他沙星外,ESBL-E一般对氟喹诺酮类耐药。2024年CHINET监测数据显示,产ESBL大肠埃希菌和肺炎克雷伯菌对环丙沙星的耐药率高达70%以上。因此该类药物不适用于ESBL-E的经验治疗。如体外药敏试验显示敏感,可用于ESBL-E泌尿系统感染的治疗。国内对尿路感染的Ⅲ期临床试验研究结果显示,西他沙星的临床疗效和微生物清除率均略高于左氧氟沙星[18]。
4.3.6 青霉烯类
青霉烯类是一类非典型β-内酰胺类抗菌药物,具有广谱抗菌活性,对β-内酰胺酶稳定,对ESBL-E有较强抗菌活性。代表药物法罗培南(口服用药),可用于呼吸系统感染、泌尿系统感染、妇科感染、皮肤软组织感染等。
4.3.7 氨基糖苷类
虽然ESBL-E常携带氨基糖苷类耐药基因[如aac(6′)-Ib、armA],但实际总体耐药率维持于10%左右,尤其是阿米卡星和异帕米星仍保持较高敏感性。单独使用氨基糖苷类治疗ESBL-E所致的感染存在疗效欠佳、耐药风险高、耳毒性与肾毒性较显著,以及组织渗透性差等局限性,因此不建议单独用药,而应与其他抗菌药物联用,应用时需谨慎评估利弊。
4.3.8 多黏菌素类
ESBL-E同时合并OMPs缺失时,可能发展为碳青霉烯类耐药菌株,此时可考虑选用多黏菌素类药物治疗。临床常用的多黏菌素类药物包括硫酸多黏菌素B、硫酸多黏菌素E和多黏菌素甲磺酸钠。然而,由于该类药物具有肾毒性和神经毒性等副作用,并存在明显的异质性耐药现象,一般用于碳青霉烯类耐药菌株所致感染的治疗。虽然体外药敏试验显示,多黏菌素对产ESBL-E菌株具有较高的敏感性,但考虑到其副作用和耐药等风险,尚不推荐临床常规用于治疗ESBL-E感染。
4.3.9 新四环素类
体外药敏试验显示,替加环素和依拉环素对ESBL-E的抗菌活性较强,而奥玛环素相对较弱。替加环素对于治疗ESBL-E导致的感染(尤其是腹腔感染)有效,但因常规剂量给药时血药浓度低,尿液中药物排泄率低,不推荐用于ESBL-E引起的血流感染和泌尿系统感染,其他适应证的感染治疗临床数据有限。依拉环素目前仅被批准用于复杂性腹腔感染,对ESBL-E的抗菌活性优于替加环素,对于其他感染类型有待更多临床研究加以证实。该类药物更多用于CRO感染(铜绿假单胞菌除外)。
4.3.10 磷霉素
体外药敏试验显示,磷霉素对产ESBL大肠埃希菌和肺炎克雷伯菌具有较强的抗菌活性。基于药代动力学(PK)/药效学(PD)特性,尿液浓度较高,因此临床主要推荐口服制剂磷霉素氨丁三醇用于下尿路感染的治疗。对于其他部位感染ESBL-E,虽然静脉注射磷霉素也有一定疗效,但通常不作为首选治疗方案,仅在特定情况下考虑使用。
4.3.11 呋喃妥因
体外药敏试验显示,呋喃妥因对产ESBL大肠埃希菌具有较强的抗菌活性。基于PK/PD特性,仅在尿液中可达有效治疗药物浓度,故临床仅适用于:(1)下尿路感染的治疗;(2)序贯治疗或维持治疗;(3)反复尿路感染的预防。
在制订ESBL-E感染治疗方案时,应采取系统化、个体化的综合管理策略。首先,必须规范采集标本的病原学检测,为精准治疗提供依据。其次,根据肠杆菌目细菌的耐药性、感染部位及病情严重程度、患者个体化特征(病理和生理状况)和抗菌药物作用特点等多维度实施分级治疗。主要原则如下:
1
早期进行规范的病原学检测,明确ESBL-E类型和感染诊断。
2
经验治疗需结合当地ESBL-E流行情况、感染来源和危险因素,评估感染风险后选择合适药物。
3
根据ESBL-E感染的严重程度选择用药:重症感染、中枢神经系统感染、血流感染、免疫低下患者感染首选碳青霉烯类药物;轻中度感染(包括肝脓肿、腹膜炎、泌尿系统感染)首选头孢哌酮/舒巴坦、哌拉西林/他唑巴坦、头霉素类及氧头孢烯类药物,效果欠佳时可升级为碳青霉烯类药物进行治疗;此外,新型β-内酰胺类/酶抑制剂复方制剂(如头孢洛生/他唑巴坦)被推荐用于ESBL-E感染的治疗,亚胺培南/瑞来巴坦、美罗培南/韦博巴坦在合并产碳青霉烯酶菌株感染时可考虑使用[19]。
抗菌药物个体化治疗方案制订原则:
1
PK/PD核心原则,包括使用剂量、间期和疗程等。当选用头孢哌酮/舒巴坦、哌拉西林/他唑巴坦时,需适当增加给药剂量和给药次数。
2
特殊人群[包括低蛋白血症、脏器功能不全、连续性肾脏替代治疗、体外膜肺氧合(ECMO)治疗者]剂量调整,必要时监测血药浓度。治疗过程中应定期评估临床疗效和安全性指标,及时调整给药方案。
5

ESBL-E各系统感染诊断和治疗
针对血流感染,具有ESBL-E感染高危因素的患者,经验治疗推荐选择碳青霉烯类药物;一旦病原学明确,应尽快转为降阶梯目标治疗;无论何种来源的感染,发现并控制原发感染灶是关键环节。[证据等级:1b;推荐强度:A]
血流感染是指患者出现全身性感染症状(如发热、寒战、低血压等)且血培养呈阳性,根据感染源可分为原发血流感染(无明确感染灶)和继发血流感染(由其他部位感染播散至血液)[20]。患者病情严重程度高、急慢性营养不良、留置导尿管、头孢菌素类及喹诺酮类抗菌药物暴露史等均为血流感染的危险因素。
5.1.1 流行病学特征
肠杆菌目细菌是血流感染的最常见致病菌。其中,产ESBL大肠埃希菌最常见,但产ESBL肺炎克雷伯菌所致的血流感染预后更差。社区获得性血流感染(CABSI):多由社区感染(如尿路感染、肺炎等)引起,病原体以大肠埃希菌、肺炎克雷伯菌为主。医院获得性血流感染(HABSI)多与医疗操作相关(如导管置入、手术等),病原体种类往往更为复杂,多重耐药菌的感染风险显著增加。
5.1.2 治疗策略
1
感染源控制:感染源明确的血流感染应积极处理原发感染灶,如导管相关血流感染(CLBSI)应尽早拔除导管,以减少细菌负荷和感染复发风险。
2
经验性治疗:血流感染与患者的不良预后密切相关,尤其是未能及时进行抗菌药物治疗和感染灶控制的情况下,患者病死率将明显升高。因此,ESBL-E所致血流感染患者应在进行病原微生物检测并明确感染源的同时尽早进行有效治疗。基于我国流行病学特征,碳青霉烯类药物仍是血流感染经验性治疗优选药物。目前循证医学证据尚不足以支持选择经验性联合方案治疗ESBL-E所致的血流感染[21]。
3
目标治疗:在明确血流感染的来源和病原体后,基于患者的病原学特点、耐药性及病情严重程度,制定个体化的治疗方案,建议在经验性治疗基础上尽早转入目标性治疗,以减少细菌耐药性的发生。ESBL-E感染治疗药物选择详见表2。
表2 ESBL-E感染治疗药物推荐表



对于中枢神经系统感染,为使药物能够达到感染部位且产生持续有效的抑菌浓度,并避免药物毒性和减少感染复发率,应选用可透过血脑屏障的抗菌药物并静脉给药,推荐首选美罗培南,必要时可联合用药,推荐疗程至少3周。[证据等级:2a;推荐强度:B]
颅内感染(通常指中枢神经系统感染),是指各类致病微生物(包括细菌、病毒、真菌及寄生虫等)侵入脑实质、脑膜或脑血管所引起的炎症性或非炎症性病变。根据病原学分类可分为细菌性感染(如化脓性脑膜炎)、病毒性感染(如单纯疱疹病毒性脑炎)、真菌性感染(如隐球菌性脑膜炎)及寄生虫感染(如脑囊虫病)等。在细菌性感染中,医院获得性革兰阴性菌脑膜炎尤为危重,其病情进展迅速,病死率为35%~50%[23],为严重的医院感染,推荐进行分子检测(如多重PCR)以提高检出率。
5.2.1 流行病学特征
近年研究显示,脑脊液中产ESBL大肠埃希菌和肺炎克雷伯菌的检出率分别为33.3%和41.9%[24-25];神经外科术后常见的革兰阴性菌为肺炎克雷伯菌、大肠埃希菌和阴沟肠杆菌等,其中ESBL-E占37.8%[26]。2016—2018年儿童脑膜炎监测数据显示,产ESBL大肠埃希菌的检出率为44.4%~49.2%,产ESBL肺炎克雷伯菌为74.3%[27]。
5.2.2 治疗策略
由于预后较差,一旦考虑患者有颅内感染时,应尽早启动经验性抗感染治疗。首先评估患者是否具有以下危险因素:年龄>65岁、女性、医疗保健相关感染史、肝硬化、患有阻塞性尿路疾病、抗菌药物(尤其是第三代头孢菌素类和喹诺酮类)使用史以及入住医疗机构。并基于PK/PD原则选择易透过血脑屏障的抗菌药物,且需全身给药。
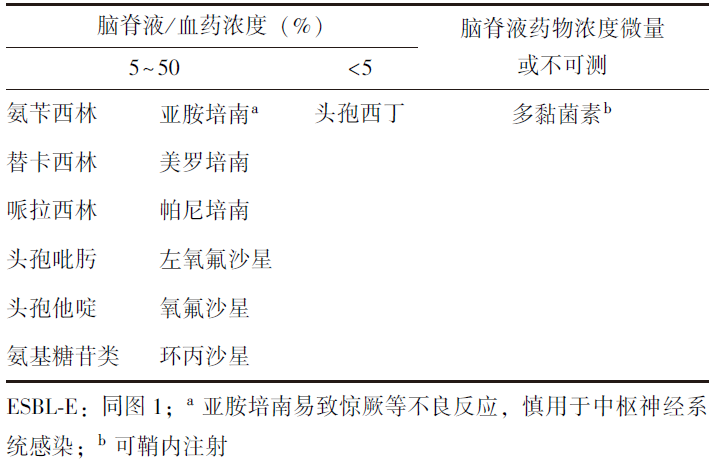
局部给药(鞘内及脑室内给药),仅为特殊状况下(如药物脑膜通透性较差)全身治疗的补充,应尽量避免泛用。治疗药物选择详见表2。基于血脑屏障对抗菌药物的影响,可参考表3予以选择。目标治疗首选碳青霉烯类药物,第四代头孢菌素类药物如头孢吡肟可用于治疗婴儿和儿童细菌性脑膜炎。
表3 ESBL-E感染治疗药物的脑脊液/血药浓度
呼吸系统感染:社区获得性肺炎、医院获得性肺炎患者应根据感染程度(重症与非重症)合理选择抗菌药物;呼吸机相关肺炎参照重症感染用药原则,推荐首选碳青霉烯类药物;胸腔感染推荐选择具有抗假单胞菌活性的药物;纵隔感染根据临床情况,必要时联合应用覆盖抗革兰阳性球菌、抗厌氧菌的药物。[证据等级:2a;推荐强度:B]
呼吸系统及胸腔纵隔感染主要包括社区获得性肺炎(CAP)、医院获得性肺炎(HAP)/呼吸机相关肺炎(VAP)、社区获得性胸腔感染、医院获得性胸腔感染以及纵隔炎。
5.3.1 流行病学特征
肠杆菌目细菌是导致HAP/VAP的常见病原体。中国医院感染抗菌药物耐药监测(CARES)数据显示,在分离自HAP和VAP的肺炎克雷伯菌中,ESBL-E的占比分别为32.4%和47.4%;大肠埃希菌中,ESBL-E的占比更高,分别为57.3%和64.7%[28]。
在CAP中,肺炎克雷伯菌、大肠埃希菌等肠杆菌目细菌感染主要见于年龄≥65岁或有基础疾病(如充血性心力衰竭、心脑血管疾病、慢性呼吸系统疾病、肾功能衰竭、糖尿病等)的住院患者。胸腔感染ESBL-E的流行病学数据较少。
5.3.2 治疗策略
5.3.2.1 经验性治疗
应考虑是否需要覆盖以肺炎克雷伯菌为代表的ESBL-E。应从两个层次分析:
1
根据感染部位、患者基础情况和相关流行病学研究结果评估肠杆菌目细菌感染的风险,如年龄≥65岁的老年CAP患者、有基础疾病的住院CAP患者、HAP/VAP患者、医院获得性胸腔感染患者、有严重基础疾病或继发于心胸外科手术的纵隔炎患者。
2
存在ESBL-E感染风险的危险因素,如ESBL-E定植或感染史、近期曾接受三代头孢菌素类治疗、反复或长期住院史、体内留置医疗器械(包括血管内导管)、肾脏替代治疗史。对于肠杆菌目细菌感染可能性较大、存在上述危险因素的患者,建议在起始经验性抗感染治疗中覆盖ESBL-E。
5.3.2.2 目标治疗
对病原微生物检测证实由ESBL-E引起的感染,建议根据感染类型、病情严重程度和致病菌的体外药敏试验结果选择抗感染药物。
1
呼吸系统感染:非重症的HAP、CAP和胸腔感染可根据体外药敏试验结果选择敏感的β-内酰胺类/酶抑制剂复方制剂、头霉素类和氧头孢烯类等抗菌药物进行治疗。VAP、重症HAP、重症CAP建议首选碳青霉烯类药物。
2
胸腔感染:建议在参照相关指南经验性覆盖金黄色葡萄球菌和铜绿假单胞菌的同时[13],兼顾ESBL-E;根据当地抗菌药物敏感性监测数据,选择对铜绿假单胞菌和ESBL-E均有较高敏感率的抗革兰阴性杆菌药物与抗革兰阳性球菌药物联用。氨基糖苷类药物的胸腔穿透性较差,而且易被酸性的感染性胸腔积液失活,不宜用于胸腔感染的治疗。重症胸腔感染、纵隔感染建议首选碳青霉烯类药物。
3
纵隔感染:必要时联合抗阳性球菌药物/抗厌氧菌药物。在β-内酰胺类抗菌药物中,应避免选择不含β-内酰胺酶抑制剂的青霉素类药物或头孢菌素类药物,优先选择碳青霉烯类抗菌药物或β-内酰胺类/酶抑制剂复方制剂。治疗药物选择详见表2。
治疗过程中适时进行疗效评估,对于疗效不佳的患者,应及时调整为碳青霉烯类药物。对于胸腔感染和纵隔感染,在恰当抗感染治疗的同时,应积极进行引流、尝试清除感染病灶[29-30]。
腹腔感染治疗的核心环节是清除感染灶,在控制感染源基础上,应根据感染严重程度选择适宜的抗菌药物治疗。抗菌药物疗效不佳时,可选择含替加环素或依拉环素的联合用药方案,注意覆盖厌氧菌。[证据等级:2a;推荐强度:B]
腹腔感染按发病场所可分为社区获得性腹腔感染(CA-IAI)、医疗机构或医院获得性腹腔感染(HA-IAI);按严重程度可分为轻中度腹腔感染[急性生理学与慢性健康状况评分Ⅱ(APACHEⅡ)<10分]和重度腹腔感染(APACHEⅡ评分≥10分或合并脓毒症或合并Ⅲ级以上急性胃肠功能损伤)[31]。
5.4.1 流行病学特征
按感染源部位及分类的不同,腹腔感染患者分离出的病原微生物类型存在显著差异,肠杆菌目细菌是腹腔感染最主要的病原体,其中大肠埃希菌和肺炎克雷伯菌的检出率最高[32]。值得注意的是,我国ESBL-E的检出率显著高于欧美国家,这可能与我国抗菌药物使用不规范、医院感染控制措施不足等因素有关。
5.4.2 治疗策略
感染源控制是腹腔感染治疗的核心环节。通过手术或介入治疗(如脓肿引流)清除感染灶,可显著提高治疗效果。对于重症腹腔感染患者,早期干预和控制感染源尤为重要。此外,腹腔感染常合并厌氧菌感染,使用同时覆盖ESBL-E和厌氧菌的抗菌药物效果更佳。治疗药物选择详见表2。
轻中度腹腔感染:若疑诊或确诊为ESBL-E,可选用β-内酰胺类/酶抑制剂复方制剂(如哌拉西林/他唑巴坦、头孢洛生/他唑巴坦、头孢哌酮/舒巴坦),联合用硝基咪唑类药物(如甲硝唑)进行治疗,并覆盖厌氧菌。
重度腹腔感染:应首选碳青霉烯类抗菌药物(如美罗培南),因其对ESBL-E和多重耐药菌具有广谱抗菌活性。在抗菌药物疗效不佳情况下,可选择含替加环素的联合用药方案。在有效控制感染源的前提下,推荐基于病原微生物学证据进行降阶梯治疗,并采用短疗程抗感染策略,以减少耐药菌的产生和抗菌药物相关不良反应。
根据泌尿系统感染的严重程度、复杂性以及位置,选择抗菌药物种类和剂型。单纯性感染或下尿路感染,推荐磷霉素、呋喃妥因等药物口服治疗;上尿路感染、复杂性感染或重症感染按需选择β-内酰胺类/酶抑制剂复方制剂、头霉素类、氧头孢烯类、碳青霉烯类并静脉用药。[证据等级:2a;推荐强度:B]
泌尿系统感染根据感染部位分为上尿路感染和下尿路感染,同时依据是否存在危险因素分为复杂性尿路感染和非复杂性(单纯性)尿路感染。复杂性尿路感染是指患者存在宿主相关因素(如糖尿病或免疫抑制)或与尿路相关的特定解剖结构或功能异常(如尿路梗阻、逼尿肌功能障碍导致的膀胱排空不全等),上述因素会增加治疗难度,并影响感染的控制和根除[33]。相比之下,非复杂性尿路感染通常发生于健康人群,无上述危险因素,且对抗菌药物治疗反应良好。
5.5.1 流行病学特征
2015—2021年CHINET监测数据显示,泌尿系统感染的主要病原菌分布如下:大肠埃希菌仍居首位,其次为肺炎克雷伯菌和奇异变形杆菌。值得注意的是,这些菌株中产ESBL的比例较高,其中产ESBL大肠埃希菌的检出率达53.2%,产ESBL肺炎克雷伯菌为52.8%,产ESBL奇异变形杆菌为37.0%[34]。这一趋势提示我国泌尿系统感染中ESBL-E的流行处于严峻态势,对临床经验性抗感染治疗的选择带来挑战。
5.5.2 治疗策略
对于ESBL-E引起的尿路感染,治疗方案需根据感染部位及严重程度进行个体化选择。急性下尿路感染,推荐采用以呋喃妥因、磷霉素氨丁三醇、法罗培南、西他沙星等口服抗菌药物为主的治疗方案;对于上尿路感染推荐以静脉给药为主,可选择β-内酰胺类/酶抑制剂复方制剂(如头孢洛生/他唑巴坦、哌拉西林/他唑巴坦、头孢哌酮/舒巴坦)、头霉素类(如头孢美唑、头孢米诺)、氧头孢烯类(如拉氧头孢)。对于尿源性脓毒症患者,初始治疗可选择碳青霉烯类药物(如厄他培南、亚胺培南、美罗培南),待病情稳定后,应根据体外药敏试验结果及时降阶梯治疗[33-35]。必要时予以原发病灶的外科处理(如解除尿路梗阻、引流感染灶)。治疗药物选择参见表2。
6

ESBL-E特殊人群治疗策略
根据中性粒细胞缺乏时间、合并症、肝肾功能、免疫状态等情况,将中性粒细胞缺乏伴发热患者按照危险度分层,低危患者参照轻中度感染、高危患者参照重症感染治疗原则选择用药。若除外脓毒血症,也可应用哌拉西林-他唑巴坦等药物单药治疗,若用后者则推荐采用合适剂量与延长输注时间。[证据等级:2a;推荐强度:B]
中性粒细胞缺乏症是指外周血中性粒细胞绝对值(ANC)低于0.5×109/L,或预计48 h内将降至该水平以下;当ANC低于0.1×109/L 时则定义为严重中性粒细胞缺乏。中性粒细胞缺乏伴发热的标准为:单次口腔温度≥38.3 ℃(对应腋温≥38.0 ℃),或持续1 h以上口腔温度≥38.0 ℃(对应腋温≥37.7 ℃)。需特别注意的是,对于全身状况较差的患者群体,特别是老年患者,在感染发生时可能不出现典型发热症状,甚至表现为体温过低等非典型临床表现,这种情况更需引起临床医师的高度重视。
6.1.1 流行病学特征
在血液肿瘤合并中性粒细胞缺乏伴感染的患者中,产ESBL大肠埃希菌和产ESBL肺炎克雷伯菌的检出率较高,分别可达50%~60%和40%~50%[36-37]。
6.1.2 治疗策略
中性粒细胞缺乏伴发热患者的抗菌药物选择应严格遵循《中国中性粒细胞缺乏伴发热患者抗菌药物临床应用指南》的危险分层策略,将患者分为高危和低危两种类型进行个体化治疗[36]。低危患者定义为中性粒细胞减少持续时间≤7 d,无严重合并症且肝肾功能基本正常,此类患者可接受门诊或住院口服/静脉经验性抗菌治疗。若存在ESBL-E感染风险,首选β-内酰胺类/酶抑制剂复方制剂(哌拉西林/他唑巴坦、头孢哌酮/舒巴坦),或采用体外药敏试验结果敏感的头孢吡肟进行单药治疗。
高危患者定义标准如下(符合以下任一项即为高危患者):
1
预计严重中性粒细胞计数减少(ANC<0.1×109/L)持续>7 d;
2
存在合并症,包括血流动力学不稳定、严重黏膜炎、显著消化道症状、新发神经精神症状、导管相关感染或新发肺部病变;
3
合并肝功能损害[丙氨酸氨基转移酶(ALT)/天冬氨酸氨基转移酶(AST)>5倍正常值]或肾功能不全[肌酐清除率(CrCl)<30 mL/min];
4
伴有免疫缺陷或正在接受靶向/免疫调节治疗。高危患者必须立即住院治疗,根据临床表现复杂性对其进行个体化评估。基于该类患者病原证据获取难,初始治疗应结合当地耐药菌流行病学特征,予以合适和高效的广谱抗菌药物。
6.1.3 治疗药物选择
6.1.3.1 用药
药物种类:高危患者,推荐选择碳青霉烯类药物(主要是亚胺培南或美罗培南)以及抗假单胞菌β-内酰胺类/酶抑制剂复方制剂(如头孢洛生/他唑巴坦、哌拉西林/他唑巴坦)单药治疗,国内学者通常也采用头孢哌酮/舒巴坦治疗。哌拉西林/他唑巴坦可以作为除严重感染外(尤其是除严重脓毒血症及感染性休克患者外)的ESBL-E感染患者的治疗选择,强烈推荐应用哌拉西林/他唑巴坦时采用合适剂量并延长输注时间。具体详见表2。
6.1.3.2 疗程
欧洲白血病感染会议指南(ECIL)(2011版)及感染病学与肿瘤学工作组(AGIHO)/德国血液病与肿瘤内科学会(DGHO)(2017版)指南推荐,对于不明原因粒缺发热ANC持续<0.5×109/L者,抗菌药物应使用至退热后7 d停药;此外,对于退热48 h、血流动力学稳定且感染症状体征缓解但ANC仍低于0.5×109/L的患者,可考虑停用抗菌药物治疗,但需密切监测24~48 h,若再次发热应立即重启抗菌药物治疗。
病原学确诊感染的治疗应至少持续7 d,直至病原微生物清除、临床症状体征完全缓解且持续退热4 d以上,即使ANC仍<0.5×109/L也可以停药;临床确诊感染的治疗方案则需根据特定病原微生物特性、感染部位及严重程度、治疗反应进行个体化制定。
对于感染ESBL-E危险因素低、无脓毒症休克、无严重免疫抑制、无合并症或多种病原体混合感染的多数急诊患者,仅需根据感染部位选择单药治疗;仅重症感染时考虑联合用药方案,同时联合体外药敏试验以开展精准治疗。[证据等级:2a;推荐强度:B]
急诊患者由于病情复杂危重,往往合并多种基础疾病和并发症,且多系统受累情况常见。此类患者通常需接受有创性抢救措施(如机械通气、各类导管置入、肾脏替代治疗等),导致其ESBL-E感染的发生率增高[38]。
6.2.1 流行病学特征
急诊ESBL-E感染的主要类型为泌尿道感染和血流感染,主要致病菌为大肠埃希菌和肺炎克雷伯菌。其危险因素包括:老年患者(≥65岁)、反复抗菌药物使用史、接受侵入性操作、长期入住医疗机构以及免疫功能低下状态等[38]。上述危险因素常共同作用,增加了急诊患者ESBL-E感染的发生风险。
6.2.2 治疗策略
准确评估急诊ESBL-E感染患者的病情严重程度对临床决策具有重要意义,直接影响预后判断、治疗场所选择和抗菌药物使用策略。临床医师需综合考虑以下关键因素:病原菌耐药特征、感染严重程度分级以及具体感染部位,从而制定个体化的抗感染治疗方案[38]。
6.2.3 治疗药物选择
绝大多数急诊ESBL-E感染患者仅需单药治疗,适用于无脓毒症休克、仅局部感染、接受抗菌药物后临床改善、无严重合并症及无其他病原体合并感染的情况。但同时要根据患者的危重程度和治疗反应及时调整抗菌药物方案。对于少数ESBL-E重症感染(如并发脓毒症休克),推荐采用联合抗菌治疗方案:碳青霉烯类或β-内酰胺类/酶抑制剂复方制剂联合喹诺酮类或氨基糖苷类抗菌药物。该方案通过协同抗菌作用提高临床疗效,但需密切监测药物不良反应。治疗药物选择详见表2。
治疗儿童ESBL-E感染,应充分考虑儿童年龄、生理功能和代谢水平的个体差异因素,严格按照说明书用药,保证疗效确切且用药安全;对于喹诺酮类、氨基糖苷类、四环素类等超说明书用药,仅可在获益远大于风险的前提下谨慎使用。[证据等级:2a;推荐强度:B]
儿童年龄跨度大,其体液成分、器官功能及代谢水平随着年龄增长呈非线性变化,与体重增长也无确切的线性关系, 故应充分考虑其特点,如儿科特殊的PK/PD特征、有无儿童适应证等,选择合适的治疗药物。
6.3.1 流行病学特征
2022年中国儿童细菌耐药监测结果显示,儿童感染肠杆菌目细菌占比居前3位的分别为大肠埃希菌、肺炎克雷伯菌和阴沟肠杆菌[39]。其中产ESBL大肠埃希菌和肺炎克雷伯菌的占比分别为 41.8%和42.3%。阴沟肠杆菌对头孢曲松耐药率为35.3%,对其他监测抗菌药物耐药率均低于30%。儿童ESBL-E感染多见于重症监护病房,其中肺炎克雷伯菌是VAP的首位致病菌;而大肠埃希菌是引起新生儿化脓性脑膜脑炎和血流感染的主要病原菌[40-41]。极低出生体重儿发生大肠埃希菌感染,临床表现多不典型(发热或低体温、腹泻、拒乳、呼吸暂停等),病情进展迅速,甚至合并休克,早期抗菌药物的合理应用是降低其病死率的关键因素[42-43]。对于诊断为化脓性脑膜脑炎或血流感染的新生儿,抗菌药物选择应考虑覆盖耐药大肠埃希菌。
2015—2021年CHINET的耐药监测显示,儿童患者分离的ESBL-E中大肠埃希菌、克雷伯菌属对头孢哌酮舒巴坦的耐药率分别为4.0%~6.8%、19.1%~29.3%;碳青霉烯类耐药率分别为2.0%~3.4%和14.1%~22.6%[7]。
6.3.2 治疗策略
6.3.2.1 根据PK/PD特征用药
在儿科患者中,PK/PD特征呈现显著的年龄依赖性变化,尤以早产儿、新生儿及婴儿期最为突出。新生儿特殊的生理特征直接影响药物代谢过程:
1
消化系统方面,新生儿胃液pH值偏高伴胃排空延迟,增加了口服药物的生物利用度;
2
体液分布方面,新生儿体液总量和细胞外液占比较高,导致水溶性药物的表观分布容积增大,从而药物初始剂量需要增大[44]。同时,药物代谢和清除受到肝肾功能发育水平及疾病本身影响。
因此,儿童ESBL-E的抗菌药物应用需充分考虑年龄和个体差异,建议严格按照说明书用药;对于缺少儿童/新生儿人群PK/PD数据的药物,需动态监测用药后的血药浓度,根据疗程、疗效和脏器情况,动态调整抗菌药物使用剂量。
6.3.2.2 用药注意事项
以下抗菌药物缺少在新生儿或儿童群体中的临床试验可能存在一些副作用,属于超说明书用药[27]:
1
氟喹诺酮类药物,如诺氟沙星(氟哌酸)、左氧氟沙星等,动物实验提示其对幼鼠骨骼发育产生不良反应,可能会影响儿童关节和软骨发育,在18岁以下儿童中属于超说明书用药;
2
氨基糖苷类药物,如庆大霉素、阿米卡星等,对儿童造成的不良反应包括耳毒性和肾毒性,因此说明书建议儿科应慎用氨基糖苷类药物;
3
四环素类药物,如四环素、多西环素、替加环素等,8岁以下儿童无适应证。
综上所述,临床医师需充分基于伦理和科学原则,权衡患儿获益与风险,遵循无替代、有证据、非试验、获批准、有知情、可监控等原则使用超说明书药物。
6.3.2.3 治疗药物选择
建议基于2023年国际指南中关于ESBL-E的抗菌药物使用推荐以及儿童/新生儿的相关用药限制[45],结合我国现有的肠杆菌耐药现状和药物准入情况进行药物选择[46]。在实际临床工作中,多选用临床已广泛应用的β-内酰胺类/酶抑制剂复方制剂或碳青霉烯类药物进行经验性治疗。此外,头孢洛生-他唑巴坦已获批从出生开始治疗儿童复杂性腹腔内感染(cIAI)和复杂性尿路感染(cUTI)[47]。
总之,对于儿童/新生儿ESBL-E的抗菌药物选择,需进行全面的个体化评估,重点考虑以下关键因素:
1 | 感染特征(部位、病原菌及严重程度); |
2 | 患儿发育特点(各年龄段特有的生理特征和PK/PD参数); |
3 | 流行病学数据(本地病原菌分布及耐药谱); |
4 | 用药史(近期抗菌药物暴露情况); |
5 | 耐药风险因素(基础疾病、免疫状态等)。 |
基于上述评估,优先选择具有明确疗效、安全性良好且不良反应可控的抗菌药物,确保治疗获益最大化而风险最小化。治疗药物选择具体见表2。
7

ESBL-E感染防控措施
加强抗菌药物临床应用管理是控制ESBL-E传播的关键策略。抗菌药物管理(AMS)是指医疗机构通过一系列干预措施,优化抗菌药物的临床使用,以改善患者预后的综合管理方案,其核心要素包括优化诊断、明确适应证、优化药物选择及给药方案(包括剂量、给药途径和疗程),从而减少不合理用药及相关不良事件,最终减少新型耐药菌的产生。
AMS的有效实施依赖于有效的领导力和行政支持、多学科共同协作、动态更新的技术支撑体系(包括基于循证医学的本机构抗菌药物应用指南制订、临床医师规范化培训与能力建设、抗菌药物使用评价与及时反馈、抗菌药物用药强度评价、艰难梭菌感染等不良结局监测、指南依从性监测和病原微生物检测方法优化等)。目前针对ESBL-E传播控制的专项干预研究仍较匮乏,亟需开展基于医疗机构特点的精准化防控策略研究。
控制细菌耐药的关键在于减少细菌对抗菌药物的暴露,从而减少耐药性的发生。医疗专业人员应严格遵循抗菌药物临床应用指南,确保用药指征明确、疗程合理,优先选择最窄谱抗菌药物满足治疗需求。针对ESBL-E流行的综合防控策略建议如下:
1
加强抗菌药物合理应用的教育培训、评价与反馈:持续不断开展抗菌药物合理应用教育、培训,同时采用对处方医师的授权、抗菌药物使用合理性评价、及时和针对性的反馈等措施。依托信息化建设,通过信息化手段实现对重点环节的智能管理。
2
强化抗菌药物处方人员的病原微生物学思维:感染性疾病的临床多样性和复杂性使其正确诊治并非易事,应从病原微生物角度对临床抗菌药物处方人员进行指导,如药敏报告的解读、感染和定植菌的区分、宏基因报告的分析和解读。
3
努力实现经验性治疗与目标治疗的统一:启动经验性治疗后应每日评估患者是否对抗菌药物有治疗反应,是否已送检标本进行培养及病原诊断检测,能否停用抗菌药物或使用更窄谱的抗菌药物,缩短经验性治疗向目标性治疗转换的时间。
4
在耐药背景下实施个体化经验性抗感染治疗需综合考虑以下因素:患者特征(年龄、器官功能状态)、感染特点(部位、严重程度分级)、耐药风险评估(流行病学数据、既往用药史)。基于PK/PD原则优化给药方案(剂量、频次、输注方式)。
5
规范三代头孢菌素临床应用:三代头孢菌素类药物具有显著的生态影响,如引起肠道微生物组成变化和多样性显著下降[48]、使危重患者气道内和会阴区肠杆菌的丰度显著增加[49]、用量与抗菌药物耐药性和产 ESBL发生率相关[50]。鉴于此,应严格限制三代头孢菌素类药物(包括头孢曲松)在围术期的预防用药,仅用于肠道革兰阴性菌污染手术的预防。
6
加强多学科会诊和抗菌药物信息化管理:针对ESBL-E导致的复杂感染,及时组织临床、微生物、药学、感染防控、护理等多学科进行协作诊治、防控。同时加强医院信息系统中关于抗菌药物管理模块建设,协助临床人员进行决策。
7.2.1 严格遵守无菌操作
合格的无菌操作对于预防操作相关感染(如手术部位感染、穿刺部位感染、介入相关感染)和器械相关感染(如CLBSI、导尿管相关尿路感染、VAP)至关重要。若无菌操作失误导致相关感染,会增加抗菌药物使用剂量以及耐药菌(包括ESBL-E)的产生及传播,因此医疗专业人员必须坚持预防为主,严格遵守无菌操作原则,严格掌握侵入性操作和留置各种导管(如血管导管、导尿管)的指征,每日进行评估并及时拔除,预防和减少侵入性操作及留置导管相关感染的发生和传播。
7.2.2 严格遵守感染控制规范
应对耐药菌感染特别强调“两手抓、两手硬”,一手抓抗菌药物合理应用与管理以减轻抗菌药物压力,延缓耐药菌产生,一手抓感染预防与控制以预防感染及传播。在防控ESBL-E感染的具体实践中,必须掌握并严格遵守感染预防与控制相关标准及规范,同时不断总结经验和开展循证研究,及时丰富和创新预防措施。
最重要的是将感染制度规范要求落实到位。根据《医务人员手卫生规范》要求做好手卫生,根据《医疗机构环境表面清洁与消毒管理规范》要求做好环境清洁与消毒,根据《医院感染监测标准》要求开展医院感染监测(包括多重耐药菌的监测),根据《医疗机构消毒技术规范》做好医院环境物体表面及器械的清洁消毒或灭菌,根据《医院隔离技术标准》要求做好耐药菌感染与定植者的隔离,根据相关标准规范要求积极开展手术部位感染、呼吸机相关肺炎、血管导管及导尿管相关感染、多重耐药菌感染等的预防与控制等。
8

小结
本共识系统梳理了ESBL-E的国内外流行病学特征,优化了临床实验室检测技术,并明确了治疗原则和关键药物选择。同时,针对不同感染源和特殊人群提出了分层精准治疗策略。此外,共识强调了感染防控措施的重要性,旨在提升医疗机构对ESBL-E的检测能力,规范诊疗流程,从而有效遏制ESBL-E的传播,降低相关发病率和病死率。本共识的发布为我国ESBL-E感染的临床管理提供了科学指导,对优化抗菌药物使用、提高感染防控水平具有重要意义,有望推动我国耐药菌感染的规范化诊疗和精准化防控。未来,本共识将随诊疗技术的进步及循证医学证据的更新而定期修订完善。

参考文献
作者贡献
卓超、徐英春、俞云松牵头制定共识框架并组建专家组,负责共识提纲编制及对共识全文进行最终审校并形成共识终稿。井然负责组织和协调专家组成员对共识内容进行修订和讨论并对所有专家意见进行汇总;卓超、井然、徐英春、俞云松、邹明祥、李军、邬靖敏、胡付品、张菁、郑波、刘正印、于湘友、邱海波、施毅、佘丹阳、冯四洲、梅雪、许巍、程剑剑、吴安华、李春辉、宗志勇、周志慧、奕巧莲负责撰写共识;所有执笔专家和编审专家共同参与共识审稿并提出修订意见,编审组专家对共识推荐意见进行评分;卓超、井然、陆旻雅、李雪根据专家意见对共识内容进行修订。
通信作者
广州医科大学附属第一医院
卓超
感染科主任,微生物科主任,主任医师,教授,博士生导师。呼吸疾病国家重点实验室细菌感染课题组负责人,中华医学会细菌感染和耐药防治分会副主任委员,中国医院协会抗菌药物合理应用工作委员会副主任委员,中国医药教育协会感染病分会(IDSC)副主任委员。
北京协和医院
徐英春
北京协和医学院临床检验诊断学系主任,博士生/博士后导师。北京市重点实验室主任,北京市国际科技合作基地负责人,国家卫生健康委抗菌药物临床应用与耐药评价专家委员会委员兼办公室主任,国家卫生健康委全国真菌病监测网国家中心主任,全国细菌耐药监测网质量管理中心负责人,欧洲EUCAST华人药敏试验委员会主任委员。
浙江省人民医院
俞云松
感染病学教授,主任医师。浙江省人民医院副院长,浙江大学求是特聘教授,浙江省卫生健康委领军人才。中国医药教育协会感染疾病专业委员会名誉主任委员,中华医学会细菌感染与耐药防治专业委员会候任主任委员。
声明:
转载的文章仅用于学术信息传播和学习,版权归原作者和原出处所有,如有侵权请联系删除。
 后可发表评论
后可发表评论

相关推荐
1
雾化吸入疗法在呼吸疾病中的应用专家共识
4.7w
2
【规范与指南】人感染H7N9禽流感诊疗方案(2017年第一版)
3.3w
3
【最新】新型冠状病毒肺炎诊疗方案-试行第五版
2.5w
4
【指南与共识】新型冠状病毒(2019-nCoV)感染的肺炎诊疗快速建议指南 (标准版)
2.2w
5
雾化吸入疗法合理用药专家共识(2024版)
1.9w
6
重磅 | 急性呼吸窘迫综合征患者机械通气指南(试行)(一)
1.7w
7
儿童肺炎支原体肺炎诊疗指南(2023年版)
1.5w
8
2015新版GOLD COPD指南摘译和解读
1.5w
9
【指南共识】2014年欧洲危重病医学会休克及血流动力学监测共识
1.4w
10
成人体外膜肺氧合技术操作规范(2024年版)
1.3w



友情链接
联系我们
 公众号
公众号
 客服微信
客服微信