登录方式
方式一:
PC端网页:www.rccrc.cn
输入账号密码登录,可将此网址收藏并保存密码方便下次登录
方式二:
手机端网页:www.rccrc.cn
输入账号密码登录,可将此网址添加至手机桌面并保存密码方便下次登录
方式三:
【重症肺言】微信公众号
输入账号密码登录
注:账号具有唯一性,即同一个账号不能在两个地方同时登录。
作者:张帅
一、COVID-19患者VTE高发的证据
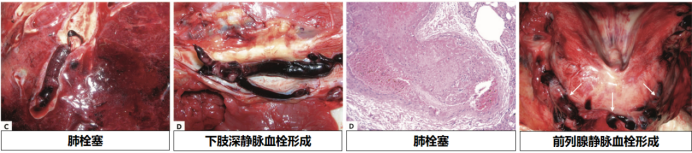

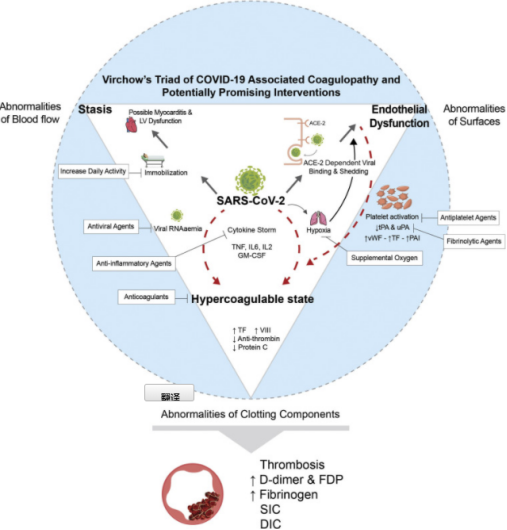


近年来一些高质量临床研究主要着眼于非ICU住院患者、ICU住院患者,以及门诊患者这三大类人群的抗凝治疗研究。
有三项高质量临床研究比较了治疗剂量和预防剂量肝素对于COVID-19非ICU住院患者的效果,包括ATTACC/ACTIV-4a/REMAP-CAP研究、RAPID研究和HEP-COVID研究。
(1)TTACC/ACTIV-4a/REMAP-CAP研究[11]:是一项开放标签、多平台、对照研究,入组COVID-19非ICU住院患者,中位年龄59岁,59%为男性,随机分为治疗量肝素抗凝组(治疗量LMWH或UFH抗凝14天或直至出院,n=1171)和预防量抗凝组(n=1048)。主要终点为无需器官支持日,次要终点包括出院时生存率、住院日、血栓或大出血事件。根据D-二聚体水平进行的亚组分析显示,高水平是指D-二聚体水平升高超过2倍上限,低水平是指D-二聚体水平升高1~2倍,可以看到,高水平D-二聚体组患者有获益。研究结果显示:与预防量抗凝相比,治疗量肝素抗凝增加了出院时生存的可能性,降低了循环或呼吸支持的使用;治疗量肝素抗凝组大出血发生率为1.9%,预防量抗凝组大出血发生率为0.9%,差异无统计学意义。
该研究得出结论:治疗量肝素抗凝延长了无需器官支持日,减少了对循环或呼吸支持的需要。但该研究存在一定的局限性,主要在于:①开放标签;②对照组抗凝强度不同,包括中间剂量抗凝组与预防剂量抗凝组;③不同研究间需判定入住ICU、预期住院日的标准不同;④仅入组了17%经筛选的患者。
(2)RAPID研究[12]:该研究入组了D-二聚体水平升高的非ICU、未应用机械通气、不需马上应用机械通气或重症监护的COVID-19住院患者。随机分组:治疗剂量LMWH或UFH(应用UFH者予负荷量后持续输注,监测APTT或抗Xa活性),预防剂量LMWH或UFH(根据体重与肌酐清除率调节剂量)。研究发现:两组间主要终点(28天内需入住ICU、无创或有创机械通气或死亡的复合终点)无显著差异。治疗剂量肝素降低了全因死亡风险(次要终点)。
(3)HEP-COVID研究[13]:该研究入组了需要氧疗、D-二聚体>4倍正常上限或脓毒症诱发的凝血异常评分(sepsis-induced coagulopathy score)≥4分的ICU或非ICU住院患者,随机分组:预防剂量或中间剂量LMWH或UFH,治疗剂量依诺肝素[Ccr≥30 ml/(min·1.73m2)者1 mg/kg bid、Ccr 15~29 ml/(min·1.73m2)者0.5 mg/kg皮下注射bid]。非ICU住院患者中,治疗剂量LMWH组在32天内包括VTE、动脉血栓、全因死亡在内的复合终点发生率显著降低;两组间32天死亡率、大出血发生率无显著差异。
(4)ACTION研究[14]:一项开放标签(盲法判定)的多中心(巴西31家中心)、随机、对照研究,入组了年龄≥18岁、D-二聚体升高、随机前14天内有COVID-19症状的住院患者。随机分组:①治疗量利伐沙班抗凝组:a. 临床稳定者住院期间口服利伐沙班20 mg或15 mg bid;b. 临床不稳定者初始应用依诺肝素1 mg/kg皮下注射bid或普通肝素静脉输注(目标抗Xa活性0.3~0.7 IU/ml),稳定后序贯利伐沙班口服直至第30天;②预防量肝素抗凝组:住院期间应用预防剂量依诺肝素或普通肝素。主要有效性终点为包括30天内发生死亡时间、住院日、氧疗日在内的复合终点,主要安全性终点为30天内大出血或临床相关非大出血。研究结果显示:与预防量肝素抗凝相比,利伐沙班治疗量抗凝未改善临床转归,且增加出血风险。因此,不推荐将利伐沙班作为COVID-19住院患者的抗凝选择。
有三项高质量的大型临床研究比较了治疗剂量/中间剂量与预防剂量肝素用于COVID-19 ICU住院患者的效果,包括REMAP-CAP/ACTIV-4a/ATTACC研究、INSPIRATION研究和COVID-PACT研究。
(1)REMAP-CAP/ACTIV-4a/ATTACC研究[15]:一项开放标签、多平台、对照研究,入组COVID-19重症患者(需应用HFNC、机械通气、ECMO或血管活性药物),随机分组为治疗剂量UFH或LMWH组(n=534)、常规治疗组(肝素剂量不同,n=564)。主要终点为无需器官支持日,次要终点包括出院时生存率、血栓事件、严重血栓和死亡复合终点、出血事件。
研究结果显示:与常规治疗相比,治疗量肝素抗凝组无需器官支持日无显著差异(aOR 0.83,95%CI 0.67~1.03),治疗量肝素抗凝组、常规治疗组生存率分别为62.7%、64.5%,大出血发生率分别为3.8%、2.3%。研究得出结论:在重症COVID-19患者中,治疗量肝素抗凝不能减少对循环或呼吸支持的需要及病死率;虽无显著差异,但治疗量肝素抗凝组出血事件增多。分析导致这样结果的原因,首先可能是由于重症COVID-19患者应用治疗量抗凝已然太迟,无法改变疾病进程;其次,COVID-19合并ARDS的患者尸检结果显示微血栓形成与肺泡出血;在存在明显肺部炎症反应时,治疗量抗凝可能加重肺泡出血,导致预后更差。
该研究的主要局限性:①开放标签;②对照组抗凝强度不同,包括中间剂量抗凝(51%)、亚治疗量抗凝(2%)抗凝;③不同研究间需判定需入住ICU、预期住院日的标准不同;④三项研究均因为治疗量抗凝未显示有效性而终止。
(2)INSPIRATION研究[16]:一项多中心随机研究,2×2 因素设计,入组COVID-19 ICU成人患者(2020-07-29至2020-11-19),中位年龄62岁,58%为男性患者,随机分为中间剂量抗凝组(依诺肝素1 mg/kg qd,n=276)、标准预防剂量抗凝组(依诺肝素40 mg qd,n=286)和他汀治疗组、安慰剂组,依据体重、肌酐清除率调节LMWH剂量。主要有效性终点为包括动静脉血栓、需要ECMO、30天内全因死亡在内的复合终点,次要有效性终点包括全因死亡、VTE,安全性终点包括大出血、严重血小板减少(PLT<20×109/L)。结果显示:与预防剂量抗凝组相比,中间剂量抗凝组主要有效性终点发生率无显著差异(45.7% vs. 44.1%;OR 1.06;95%CI 0.76~1.48)。预防剂量抗凝组、中间剂量抗凝组大出血发生率分别为1.4%、2.5%,差异无统计学意义(P=0.33);大出血和临床相关非大出血发生率分别为3.1%、6.2%,差异无统计学意义(P=0.08)。
该研究结论为:在COVID-19 ICU成人患者中,与标准剂量预防性抗凝相比,中间剂量的预防性抗凝不能减少包括动静脉血栓、需要ECMO、30天内全因死亡在内的复合终点的发生率。不支持在COVID-19 ICU成人患者中常规经验性应用中间剂量进行预防性抗凝。研究的主要局限性:①开放标签;②并非所有患者都接受了ICU级别的照护。
(3)COVID-PACT研究[17]:一项多中心、2×2因素设计研究,入组COVID-19 ICU患者,随机分为治疗剂量抗凝组(FDAC,静脉UFH或皮下LMWH)、标准预防剂量抗凝组(SDPAC,皮下UFH或LMWH),同时随机分组为氯吡格雷抗血小板治疗组与无抗血小板治疗组。主要有效性终点为包括28天或住院期间因动静脉血栓而死亡、肺栓塞、临床证实的DVT、1型心肌梗死、缺血性卒中、体循环栓塞性事件、急性下肢缺血、临床无症状DVT在内的等级性复合终点。主要安全性终点为致死性或危及生命的出血,次要安全性终点为中至重度出血。但由于入住ICU的COVID-19患者减少、入组困难,于2022年3月提前终止,入组了计划量的大约50%的患者。
研究结果显示:治疗剂量抗凝组(FDAC)、标准预防剂量抗凝组(SDPAC)主要有效性终点发生率分别为9.9%(19/191)、15.2%(29/191)(P=0.046)。FDAC、SDPAC组主要安全性终点发生率分别为2.1%、0.5%(P=0.19);次要安全性终点发生率分别7.9%、0.5%(P=0.002)。FDAC、SDPAC组间全因死亡率无显著差异(P=0.70)。氯吡格雷组与无抗血小板组间主要有效性、安全性终点发生率均无显著差异。
研究结论:在COVID-19 ICU患者中,足量治疗量抗凝治疗而非氯吡格雷抗血小板治疗可减少血栓性并发症,但增加出血风险,对病死率无明显影响。该研究的主要局限性:①开放标签;②疫情期间入组缓慢提示患者选择可能影响本研究结果的普适性;③因入住ICU的COVID-19患者减少、入组困难,提前终止。
除了上述几项大规模临床研究,还有一些COVID-19住院患者抗血小板治疗的研究。ACTIV-4a研究入组非ICU住院患者,比较治疗量肝素+P2Y12抑制剂×14天(或直至出院)与治疗量肝素的效果,结果显示21天内无需器官支持日、28天内大出血事件均无显著差异。RECOVERY研究比较了阿司匹林150 mg qd抗血小板治疗(直至出院)与抗血小板治疗在住院患者中的临床疗效,结果发现28天全因死亡率、28天内需机械通气或死亡、血栓事件均无显著差异,且阿司匹林组28天大出血发生率增加。REMAP-CAP研究在ICU患者中比较了阿司匹林75~100 mg qd或P2Y12抑制剂×14天(或直至出院)与无抗血小板治疗的临床效果,结果显示21天内无需器官支持日、住院期间死亡率均无显著差异,抗血小板治疗组90天生存率、14天内大出血增加。COVID-PACT研究纳入ICU患者,在氯吡格雷300 mg随机当天→75 mg qd×28天(或直至出院)与无抗血小板治疗进行了比较,结果发现28天或住院期间动静脉血栓、出血事件无显著差异。整体而言,抗血小板药物用于COVID-19患者的血栓的预防并无明显获益。
对于COVID-19门诊患者,积极的抗凝治疗能否给患者带来获益?OVID研究和ETHIC研究均入选了症状性、非住院门诊患者,预防性抗凝组均使用依诺肝素,对照组无抗凝。这两项研究发现,门诊患者使用预防性肝素抗凝,虽然没有导致明显的出血,但并不能带来获益,因此也不推荐对门诊患者常规使用预防剂量的肝素进行抗凝治疗。
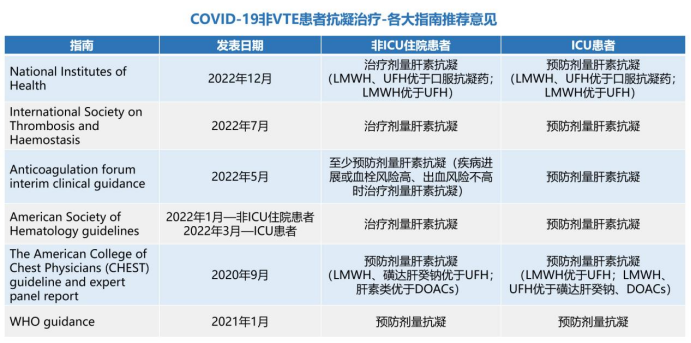
在非ICU住院患者中,治疗量肝素抗凝可以带来获益,因此推荐对于在非ICU的普通病房住院患者,如果没有明显的抗凝禁忌和高出血风险,可给予治疗量肝素抗凝。对于ICU患者,治疗量和中间量的肝素抗凝并不能带来获益,而且可能导致出血风险增加,因此对于这部分患者,推荐预防量肝素抗凝。对于门诊患者,预防量肝素抗凝没有获益,因此不做推荐。

参考文献
[1] Danzi G B, Loffi M, Galeazzi G, et al. Acute pulmonary embolism and COVID-19 pneumonia: a random association?[J]. Eur Heart J, 2020, 41(19):1858.
[2] Deitelzweig S, Luo X, Nguyen J L, et al. Thrombotic and bleeding events, mortality, and anticoagulant use among 546,656 hospitalized patients with COVID-19 in the United States: a retrospective cohort study[J]. J Thromb Thrombolysis, 2022, 53(4):766-776.
[3] Marchandot B, Trimaille A, Curtiaud A, et al. Thromboprophylaxis: balancing evidence and experience during the COVID-19 pandemic[J]. J Thromb Thrombolysis, 2022, 53(4):799-808.
[4] Wichmann D, Sperhake J, Lütgehetmann M, et al. Autopsy Findings and Venous Thromboembolism in Patients With COVID-19: A Prospective Cohort Study[J]. Ann Intern Med, 2020, 173(4):268-277.
[5] Schulman S, Hu Y, Konstantinides S. Venous Thromboembolism in COVID-19[J]. Thromb Haemost, 2020, 120(12):1642-1653.
[6] Talasaz A H, PSadeghipour P, Kakavand H, et al. Recent Randomized Trials of Antithrombotic Therapy for Patients With COVID-19: JACC State-of-the-Art Review[J]. J Am Coll Cardiol, 2021, 77(15):1903-1921.
[7] Poor H D. Pulmonary Thrombosis and Thromboembolism in COVID-19[J]. Chest, 2021, 160(4):1471-1480.
[8] Leentjens J, van Haaps T F, Wessels P F, et al. COVID-19-associated coagulopathy and antithrombotic agents-lessons after 1 year[J]. Lancet Haematol, 2021, 8(7):e524-e533.
[9] Farkouh M E, Stone G W, Lala A, et al. CAnticoagulation in Patients With COVID-19: JACC Review Topic of the Week[J]. J Am Coll Cardiol, 2022, 79(9):917-928.
[10] Schulman S, Sholzberg M, Spyropoulos A C, et al. ISTH guidelines for antithrombotic treatment in COVID-19[J]. J Thromb Haemost, 2022, 20(10):2214-2225.
[11] ATTACC Investigators, ACTIV-4a Investigators, REMAP-CAP Investigators, et al. Therapeutic Anticoagulation with Heparin in Noncritically Ill Patients with Covid-19[J]. N Engl J Med, 2021, 385(9):790-802.
[12] Sholzberg M, Tang G H, Rahhal H, et al. Effectiveness of therapeutic heparin versus prophylactic heparin on death, mechanical ventilation, or intensive care unit admission in moderately ill patients with covid-19 admitted to hospital: RAPID randomised clinical trial[J]. BMJ, 2021 Oct 14;375:n2400. doi: 10.1136/bmj.n2400.
[13] Spyropoulos A C, Goldin M, Giannis D, et al. Efficacy and Safety of Therapeutic-Dose Heparin vs Standard Prophylactic or Intermediate-Dose Heparins for Thromboprophylaxis in High-risk Hospitalized Patients With COVID-19: The HEP-COVID Randomized Clinical Trial[J]. JAMA Intern Med, 2021, 181(12):1612-1620.
[14] Lopes R D, Pedro Gabriel Melo de Barros E Silva, Furtado R H M, et al. Therapeutic versus prophylactic anticoagulation for patients admitted to hospital with COVID-19 and elevated D-dimer concentration (ACTION): an open-label, multicentre, randomised, controlled trial[J]. Lancet, 2021, 397(10291):2253-2263.
[15] REMAP-CAP Investigators, ACTIV-4a Investigators, ATTACC Investigators, et al. Therapeutic Anticoagulation with Heparin in Critically Ill Patients with Covid-19[J]. N Engl J Med, 2021, 385(9):777-789.
[16] INSPIRATION Investigators, Sadeghipour P, Talasaz A H, et al. Effect of Intermediate-Dose vs Standard-Dose Prophylactic Anticoagulation on Thrombotic Events, Extracorporeal Membrane Oxygenation Treatment, or Mortality Among Patients With COVID-19 Admitted to the Intensive Care Unit: The INSPIRATION Randomized Clinical Trial[J]. JAMA, 2021, 325(16):1620-1630.
[17] Bohula E A, Berg D D, Lopes M S, et al. Anticoagulation and Antiplatelet Therapy for Prevention of Venous and Arterial Thrombotic Events in Critically Ill Patients With COVID-19: COVID-PACT[J]. Circulation, 146(18):1344-1356.
作者简介
张帅
中日友好医院呼吸与危重症医学科主治医师、医疗组长
长期致力于肺栓塞、肺动脉高压等肺血管疾病的临床与转化医学研究
入选中日友好医院“菁英计划”人才培育工程
第一作者发表SCI论文10篇,核心期刊论文多篇
参编/译呼吸与危重症医学专著2部
 后可发表评论
后可发表评论

相关推荐
1
詹庆元教授|关于制作「重症COVID-19临床救治专家推荐意见临床实施简表」的推荐及说明
7485
2
翟振国教授|重症新冠患者的抗凝治疗:如何平衡血栓和出血的风险
6920
3
重症新冠病毒感染的呼吸支持治疗
4623
4
COVID-19炎症因子及免疫失衡指标&共感染
4270
5
重症COVID-19病例分享-2
3996
6
重症新冠合并感染的临床流行病学
3721
7
新冠病毒肺部感染影像学特征及动态演变
3576
8
我国Omicron变异株所致重症COVID-19的流行病学
3441
9
重症新冠肺炎的临床表现
3422
10
詹庆元教授:重症新冠感染救治的几个关键问题
3240



友情链接
联系我们
 公众号
公众号
 客服微信
客服微信