登录方式
方式一:
PC端网页:www.rccrc.cn
输入账号密码登录,可将此网址收藏并保存密码方便下次登录
方式二:
手机端网页:www.rccrc.cn
输入账号密码登录,可将此网址添加至手机桌面并保存密码方便下次登录
方式三:
【重症肺言】微信公众号
输入账号密码登录
注:账号具有唯一性,即同一个账号不能在两个地方同时登录。
作者:刘辉
单位:河南省人民医院呼吸与危重症医学科


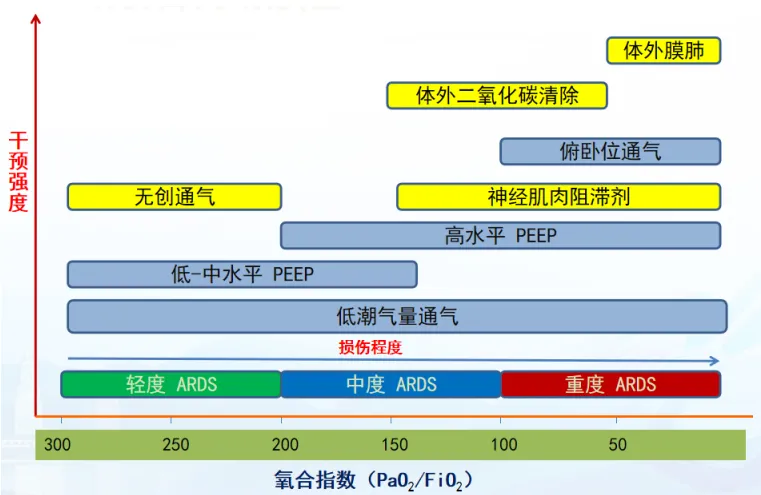
图1 ARDS的治疗策略

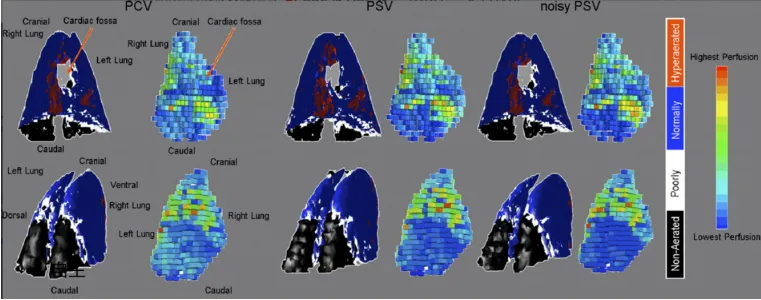


保留自主呼吸可以促进肺复张、促进肺内气体及灌注再分布、防止VIDD的发生。VV-ECMO可以显著改善ARDS患者的呼吸生理状况,调节患者的呼吸驱动。在AECOPD患者中,ECCO2R可以降低气管插管率,减少VAP发生,缩短住ICU时间。因此,在ECMO支持过程中,如果能够降低患者的呼吸驱动,可以保留自主呼吸。
参考文献
作者介绍
 后可发表评论
后可发表评论




友情链接
联系我们
 公众号
公众号
 客服微信
客服微信