一、病情介绍
患者,男性,58岁;主诉:声嘶12年,咳嗽伴咯血8年,加重伴憋气9个月。
12年前劳累后发声困难,当地喉镜检查提示声带息肉。
10年前当地医院行声带息肉切除,病理提示炎性。
8年前出现咳嗽、黄黏痰,伴痰中带血,每日2~3口,此后出现发热,伴咳嗽、咯血加重。于当地医院查胸部CT:气管、支气管管壁增厚;支气管镜检查示支气管多处狭窄、气管壁略厚。病理提示刚果红染色阴性。
9个月前出现憋气,当地医院查喉镜检查提示右侧声带新生物。
2023年3月行喉镜下激光联合等离子喉肿物切除术,术后病理显示:上皮下胶原样及淀粉样物质沉积;免疫组化示Ⅳ型胶原纤维(间质部分阳性);刚果红染色阳性,并且偏振光显微镜下为双折光“苹果绿”色(阳性)。术后患者憋气未完全缓解。
1个月前发热,伴憋气症状加重,可闻及喉鸣音。胸部CT提示“气管、支气管管壁弥漫性不规则增厚,右肺上叶实变影,双侧胸膜肥厚”。
5天前发热。甲型流感病毒核酸阳性,血气分析提示Ⅰ型呼吸衰竭。
在外院住院期间完善其他相关检查:喉肿物免疫组化,κ(间质弱阳性),λ(间质强阳性)。血IgG4亚型0.273 g/L;血尿免疫固定电泳(IFE)阴性。余ANA谱及自身抗体谱均阴性,补体正常,ANCA阴性。
高血压2年余,口服苯磺酸氨氯地平降压治疗。分泌性中耳炎2年余,表现为持续耳鸣、耳闷,间断右耳鼓膜置管治疗。吸烟史20余年,20支/日,已戒烟8年。饮酒史30年,2两/日,已戒酒8年。育有1女,家族中无类似病史及遗传病史,余无特殊。
T 36.4℃,P 78次/min,R 20次/min,BP 120/80 mmHg。喉鸣音明显,双肺呼吸音粗,可闻及呼吸双相干啰音。心、腹查体无特殊。
气管支气管增厚伴狭窄,气管支气管淀粉样变性可能;喉淀粉样变性;肺部感染;呼吸衰竭;高血压病3级(极高危);分泌性中耳炎。
肺功能检查提示重度阻塞性通气功能障碍,伴有气体潴留残气量增加。F-V曲线为典型的大气道固定阻塞图形,并且阻塞程度非常严重(图1)。
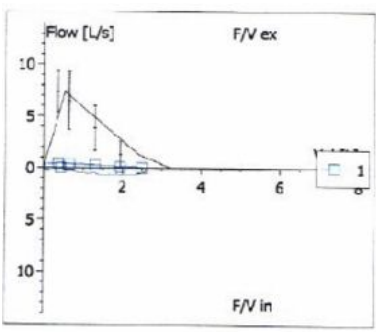
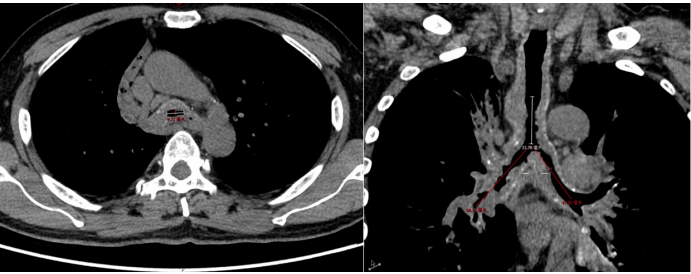
图2 患者胸部CT
该患者气道病变特点为:气管、左右主支气管、右中间段支气管弥漫狭窄;气管狭窄最严重处为8 mm;气道淀粉样变可能性大,出血风险高。此外,胸部CT可见肺内弥漫磨玻璃影。结合患者甲流阳性,考虑甲流肺炎的可能性大。
二、气与血之争
患者明确有弥漫的管腔狭窄,并且导致了比较明显的呼吸功能损害,因此具有介入治疗指征。但如何保证术中通气?
患者存在严重的通气功能损害,影像学可见明确的中心气道内生性狭窄,因此需要清除病损组织,消减病变组织体积。但此患者病变弥漫,且最狭窄处位于隆突,是最为危险的类型,处理一侧远端时,对侧通气难以保证;一旦出血,将会雪上加霜,完全阻塞通气,危及患者生命。
针对此种情况,我们考虑能否在体外生命支持(ECLS)情况下进行介入治疗。ECLS支持下可以不再顾虑治疗相关的一过性气道阻塞,提供良好的术中氧供。但需要注意的是,该患者考虑气道淀粉样变性,此类病变具有出血高风险,如何做好出血风险与抗凝管理至关重要。
气道介入治疗中常用的ECLS技术包括两种:体外循环(CBP)和体外膜肺氧合(ECMO)。CBP是通过多根引流端将血收集到一个储血器中(ECMO中没有的),储血器中的血通过主泵的动力和氧合器氧合后,经过微血栓滤器处理,从主动脉中回到体循环。多根引流管的建立,储血器的存在,有利于术中左房的充分引流,心脏完全放空,也方便进行容量管理,方便用药,但也增加了空气和血液接触,而且CBP的泵是滚压泵,转子连接滚轴,通过滚轴的滚压作用,推动血流前进,增加血液破坏。以上特征决定了在CBP中抗凝必须充分,ACT必须达到450 s以上。如果同时还要处理高危出血气道,出血风险就会进一步增加。所以,CBP在解决出血引发的缺氧问题的同时,也会加重出血。ECMO是一个单向闭合回路,并且使用离心泵,只需要适当抗凝(ACT 160~220 s)就可以维持设备运转,在一些特殊情况下,甚至可以通过使用肝素涂层管路、提高转速等方式,实现短时间的无肝素抗凝运转。因此对于该患者,使用ECMO更为合适。但仍需评价患者的心脏功能究竟如何,判断是否出现淀粉样变性的心肌受累,评估术中心脏事件风险,以确定ECMO的转机模式。
我们对患者进行了术前评估。超声心动图显示患者射血分数为61.6%,左室收缩功能及心脏结构正常,右室功能也正常。在这种情况下:如果选择体外循环,则需全量肝素,可能导致出血加重。如果选择V-A ECMO,难以避免发生“南北综合征”。如果选择V-V ECMO,既可以保证术后氧合,也可以在短时间无肝素。
三、诊疗经过
针对该患者,我们选择V-V ECMO辅助下介入治疗。操作流程为:留置管路,预冲→ 置入管路→全麻诱导→插入硬镜。在插入硬镜之后,患者氧合即刻下降,SpO2由98%降至88%,于是尝试ECMO转机,然而血流量无法达到目标。
分析氧合下降的原因:①麻醉诱导之后,患者自主呼吸驱动消失,完全依靠硬镜喷射通气来满足患者的通气需求,但对于有气道固定狭窄的患者,硬镜喷射通气本身就是一个开放气道,如果头端阻力特别大,进入肺内的有效通气会非常少,因此很多气流通过开放端流失。②ECMO流量低,快速超声检查提示左室运动良好,KISS征阳性,IVC 0.95 cm,有效容量不足。
我们将硬镜插过气管狭窄段,隆突上3 cm左右,以克服气道阻力,改善了由于固定狭窄阻力导致的通气下降;另外,通过静脉通路快速补液,ECMO流量升高,之后转机辅助效果更好,氧合得以维持。
术中可见气管中下段、隆突、左/右主支气管弥漫狭窄,右主支气管狭窄为著,黏膜弥漫隆起,凹凸不平,1TQ290支气管镜不能窥及右主远端。反复冻切右主开口,开通右主支气管,右上叶支气管开口闭塞,右中间段支气管开口及其远端支气管受累狭窄,依次治疗右主→左主→气管病变,术中气道反复出血,交替使用APC电凝及冷冻切除。术后大部分管腔较强更为通畅(图3)。
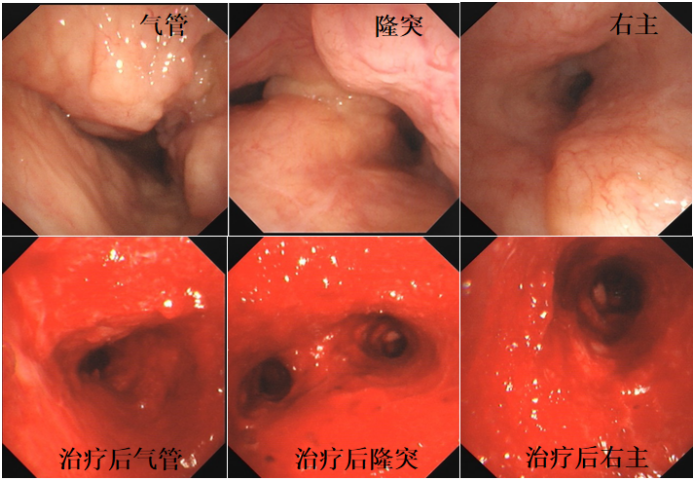
术后转入RICU,次日顺利拔除气管插管,转入普通病房。此后2周内接受了3次全麻支气管镜,清理气道内坏死物,症状显著改善,顺利出院。
四、病因探寻
针对淀粉样变性,无论是喉部还是气道中出现淀粉样变性,我们都要明确是局限的还是系统性的淀粉样变性。如果是气道局部特发性淀粉样变性,需要局部治疗。如果是系统性淀粉样变性,可能需要进行化疗。
我们对患者进行了全面评估:①气道组织活检:支气管黏膜组织伴广泛嗜伊红变性及钙化、骨化、软骨化,刚果红染色阳性;免疫组化染色:Lambda阳性,Kappa阴性。②骨髓活检:骨髓间质内少许浆细胞浸润,Lambda阳性,Kappa个别阳性,刚果红染色阴性。③心肌增强MRI:心室基底部间隔壁延迟强化,T1值延长,符合心肌淀粉样变性。由于当时患者呼吸功能时好时坏,住院期间并未进行心肌活检。④血液学检测:血/尿免疫固定电泳阴性,血游离轻链κ/λ 0.48,IgG 6.73 g/L(↓)。
我们将气道病理标本进行了质谱分析,质谱显示的谱图数丰度相对最高,但不是特别典型,根据质谱只能提示Kappa可能性大,倾向于AL-κ。
出院诊断为:①系统性淀粉样变性AL-κ型,喉、气管、双侧支气管受累,Ⅱ型呼吸衰竭,心脏、骨髓受累不除外;②病毒性肺炎;③高血压病3级(极高危);④分泌性中耳炎。
五、ECMO在呼吸介入中的应用
2023年四川大学华西医院的几位学者在Front Oncol 杂志发表了一篇Review,该文纳入48篇文章107例因严重气道问题而接受ECMO支持的患者,其中VV-ECMO 89例,VA-ECMO 18例。应用的主要介入治疗是气道支架置入或取出以及置换。讨论中也提到,这些患者考虑使用ECMO主要认为在支架置入或取出过程中可能会引起一过性通气阻塞。如果不能很好地使支架复张或快速移除,可能会导致较长时间的无通气状态,因此这种情况需要ECMO支持。这些患者的整体并发症比较少,有11例患者有过少量并发症,其中1例患者因并发症死亡,该患者的死因是严重的气道出血。气道出血也是最常见的一种并发症,与抗凝管理有关。其他并发症如动静脉瘘、静脉破裂血肿、足部缺血等相对少见。在纳入的107例患者中,ECMO主要适应证为肿瘤相关的气道阻塞,占比达到66%,其次是术后气道塌陷或狭窄,占比19%。
结合文献以及我们的经验,在呼吸介入操作中预防性安置ECMO的适应证包括:①全身麻醉后可能无法通气(常见于气管软化和严重的外压狭窄);②手术操作难度大、时间长,易致狭窄位置组织或声门水肿(尤其是气管上段声门下)进而导致无法通气;③手术易出血或组织脱落致完全梗阻窒息;④常规通气手段难以实施手术。
ECMO过程中比较难的工作是抗凝管理,这在很大程度上决定了手术能否顺利,其中精准控制凝血指标至关重要,例如床旁实时监测APTT、ACT。如果有条件,尽可能使用低肝素或无肝素ECMO,肝素涂层的ECMO管路在相对较短时间的手术中有一定优势。此外,在介入方面还要有充分的止血措施,例如止血球囊、APC止血设备,必要时也可寻求胸外科或介入血管外科的帮助。
参考文献
[1] Lee J H, Yum H K, Jamous F, et al. Diagnostic procedures and clinico-radiological findings of acute fibrinous and organizing pneumonia: a systematic review and pooled analysis[J]. Front Oncol, 2023, 13:1098594.
作者简介
 后可发表评论
后可发表评论




友情链接
联系我们
 公众号
公众号
 客服微信
客服微信