登录方式
方式一:
PC端网页:www.rccrc.cn
输入账号密码登录,可将此网址收藏并保存密码方便下次登录
方式二:
手机端网页:www.rccrc.cn
输入账号密码登录,可将此网址添加至手机桌面并保存密码方便下次登录
方式三:
【重症肺言】微信公众号
输入账号密码登录
注:账号具有唯一性,即同一个账号不能在两个地方同时登录。
一、吸气肌的组成与吸气过程
参与人体吸气的主要呼吸肌为膈肌和肋间外肌,当吸气不足或需要辅助呼吸肌参与的情况下,还会涉及胸锁乳突肌、斜角肌群和胸小肌。一些慢性呼吸系统疾病患者的肋间外肌和膈肌会出现萎缩,但其辅助呼吸肌,特别是胸锁乳突肌在吸气时非常明显。与吸气不同,正常人在平静呼气时是被动的弹性回缩,不做功,也不需要肌肉过多参与,但对于一些吸气不足或呼吸困难患者,需要用力呼气,此时就需要肋间内肌、腹(腹直肌、腹外斜肌)肌和腰方肌群的参与。
二、呼吸肌的功能
(4)其他:姿势控制,核心稳定性,胃肠蠕动,胃食管反流,吞咽。
三、呼吸肌功能的影响因素
无创通气与膈肌功能障碍也相互影响。膈肌功能障碍患者更容易出现无创通气失败,而且死亡率更高。而无创通气失败患者的膈肌增厚分数仅有14.3%。正常情况下,如果膈肌增厚分数低于20%,不建议脱离无创通气,而是需要进一步的呼吸支持。正常膈肌在收缩时会表现出血流供应增加以满足收缩活动的供氧需求。机械通气时间延长导致膈肌血流供应能力下降且通气时间越长,血流供应越少。这种损害的结果可能是导致脱机困难的主要原因。动物研究发现,当增加PEEP时,大鼠的膈肌长度会变短,而且产生的最大肌力会下降(即纵向萎缩)。
四、呼吸肌功能的评估
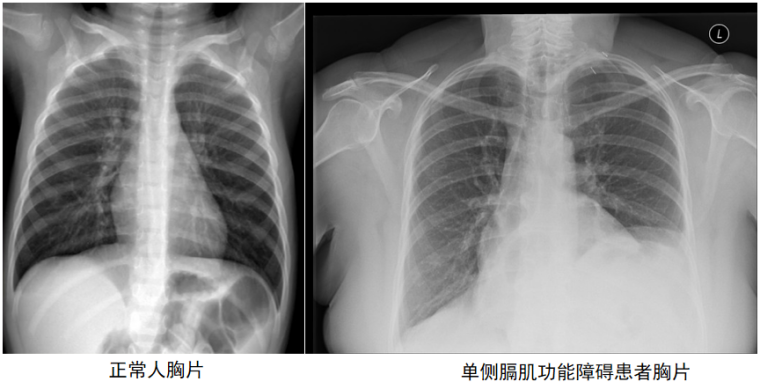

通过观察呼吸形式的改变,如浅快呼吸、腹式矛盾呼吸、辅助呼吸肌参与明显,也可以评估呼吸肌功能障碍。
五、呼吸肌功能障碍的治疗
膈肌保护性机械通气的原则:①滴定呼吸机支持;②保持跨膈压;③保持膈肌增厚分数15%~30%;④对Tfdi>30%~50%的患者在其他呼吸参数的监测下,增加呼吸支持。
六、康复方案实施中的疑问及解决
口面肌功能治疗(orofacial myofunctional therapy,OMT)包括针对口腔和口咽结构的等张力和等长运动,目的是增加肌肉张力耐力和咽周围肌肉的协调运动。肌功能疗法有助于儿童和成人OSA患者重新定位舌头,改善鼻腔呼吸,并增加肌肉张力。OMT在单一或联合靶向治疗OSA中的有效性需要多中心临床研究证实。
七、总结
呼吸肌功能障碍是ICU患者及呼吸病房患者的常见问题,但常常被忽视。呼吸肌功能可以是量化的指标,通过多维度进行评估,ICU患者更多需要采取被动方式监测。呼吸肌的锻炼需要选择合适的时机,制定个体化方案,进行动态监测,尤其是病因的分析,结合病因的呼吸肌功能训练在临床中非常重要。
参考文献(向下滑动查看全部文献)
[1] Polkey MI, Harris ML, Hughes PD, et al. The contractile properties of the elderly human diaphragm[J]. Am J Respir Crit Care Med, 1997, 155(5):1560-1564.
[2] Supinski GS, Morris PE, Dhar S, et al. Diaphragm Dysfunction in Critical Illness[J]. Chest, 2018, 153(4):1040-1051.
[3] Ottenheijm CA, Heunks LM, Li YP, et al. Activation of the ubiquitin-proteasome pathway in the diaphragm in chronic obstructive pulmonary disease[J]. Am J Respir Crit Care Med, 2006, 174(9):997-1002.
[4] Levine S, Kaiser L, Leferovich J, et al. Cellular adaptations in the diaphragm in chronic obstructive pulmonary disease[J]. N Engl J Med, 1997, 337(25):1799-1806.
[5] Orozco-Levi M, Lloreta J, Minguella J, et al. Injury of the human diaphragm associated with exertion and chronic obstructive pulmonary disease[J]. Am J Respir Crit Care Med, 2001, 164(9):1734-1739.
[6] Scott A, Wang X, Road JD, et al. Increased injury and intramuscular collagen of the diaphragm in COPD: autopsy observations[J]. Eur Respir J, 2006, 27(1):51-59.
[7] Santana PV, Prina E, Albuquerque ALP, et al. Identifying decreased diaphragmatic mobility and diaphragm thickening in interstitial lung disease: the utility of ultrasound imaging[J]. J Bras Pneumol, 2016, 42(2):88-94.
[8] Antenora F, Fantini R, Iattoni A, et al. Prevalence and outcomes of diaphragmatic dysfunction assessed by ultrasound technology during acute exacerbation of COPD: A pilot study[J]. Respirology, 2017, 22(2):338-344.
[9] Lindqvist J, van den Berg M, van der Pijl R, et al. Positive End-Expiratory Pressure Ventilation Induces Longitudinal Atrophy in Diaphragm Fibers[J]. Am J Respir Crit Care Med, 2018, 198(4):472-485.
[10] Masmoudi H, Coirault C, Demoule A, et al. Can phrenic stimulation protect the diaphragm from mechanical ventilation-induced damage[J]. Eur Respir J, 2013, 42(1):280-283.
[11] Fossmo HL, Holtebekk E, Giltvedt K, et al. Physical exercise in adults with hereditary neuromuscular disease[J]. Tidsskr Nor Laegeforen, 2018, 138(11). doi: 10.4045/tidsskr.17.1024.
[12] 李庆云, 张柳. 阻塞性睡眠呼吸暂停发病的上气道扩张肌机制及对策[J]. 中华结核和呼吸杂志, 2023, 46(12):1154-1156.
[13] Koka V, De Vito A, Roisman G, et al. Orofacial Myofunctional Therapy in Obstructive Sleep Apnea Syndrome: A Pathophysiological Perspectivep[J]. Medicina (Kaunas), 2021, 57(4):323.
作者简介
 后可发表评论
后可发表评论




友情链接
联系我们
 公众号
公众号
 客服微信
客服微信