登录方式
方式一:
PC端网页:www.rccrc.cn
输入账号密码登录,可将此网址收藏并保存密码方便下次登录
方式二:
手机端网页:www.rccrc.cn
输入账号密码登录,可将此网址添加至手机桌面并保存密码方便下次登录
方式三:
【重症肺言】微信公众号
输入账号密码登录
注:账号具有唯一性,即同一个账号不能在两个地方同时登录。
作者:郭晨霞
一、病情介绍
血常规:WBC 7.9×109/L,Hb 127 g/L(↓),PLT 307×109/L,LYM% 9.2%(↓),NEU% 83.6%(↑)。快速CRP 105.1 mg/L(↑)(0~10 mg/L)。
生化组合:LDH 547 U/L(↑)、肝肾功、电解质、心肌酶均正常。
血气分析(未吸氧):pH 7.563,PaO2 55 mmHg,PaCO2 27.9 mmHg,HCO3- 24.6 mmol/L,Lac 1.58 mmol/L,氧合指数262 mmHg。
尿便常规(-)
血PCT正常,血培养未见细菌生长。
痰:呼吸道病原菌核酸七项(肺炎链球菌、金黄色葡萄球菌、耐甲氧西林葡萄球菌、肺炎克雷伯菌、铜绿假单胞菌、鲍曼不动杆菌、嗜麦芽窄食单胞菌、流感嗜血杆菌)、呼吸道病原体核酸七项(甲型流感病毒H1N1/H3N2、乙型流感病毒、呼吸道合胞病毒、人副流感病毒、腺病毒、肺炎支原体、肺炎衣原体)均为阴性。
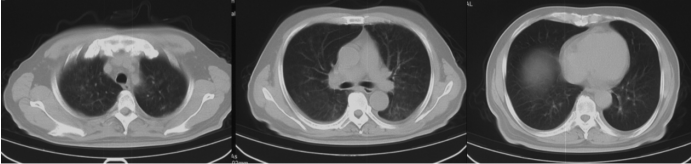
二、入院诊疗
①肺部感染?②Ⅰ型呼吸衰竭;③前列腺癌,多发骨转移。
入院后收入感染科病房,行病原学检查:
血NGS(DNA+RNA):未见病原体。
支气管镜下见气道大致正常,于左肺上叶舌段行支气管肺泡灌洗,灌入生理盐水150 ml,回收40 ml。
BALF细胞计数及分类:细胞计数17×104/ml(↑),巨噬细胞占比12%(↓),淋巴细胞占比83%(↑),中性粒细胞占比5%(↑),嗜酸性粒细胞0。
BALF找肿瘤细胞:未见。
BALF NGS(DNA+RNA):未回报病原体。
入院后予哌拉西林舒巴坦5g q8h+磺胺3片tid+甲强龙40mg qd治疗(图3)。4月12日患者呼吸困难加重,氧合指数下降至150 mmHg,转入RICU。
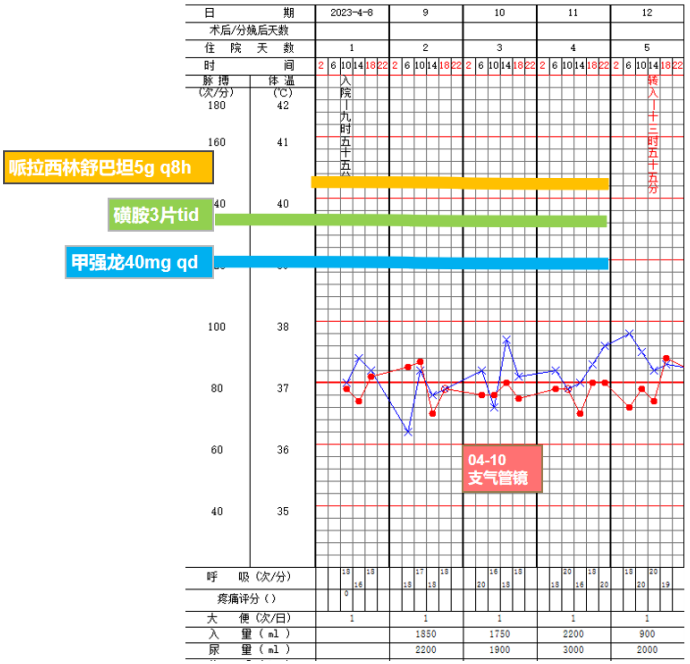
图3 患者转入RCIU前治疗及生命体征变化情况
三、转入RICU诊疗
铁蛋白906 ng/ml(↑)。
血淋巴细胞亚群:CD8 119/μl(↓),B淋巴细胞70.06/μl(↓),T淋巴细胞CD3 558.23/μl(↓)。
PPD试验、结核菌抗体、布氏杆菌抗体均正常。
甲状腺功能正常。
4月13日再次行支气管镜检查,左舌叶灌入生理盐水80 ml,回收40 ml。
BALF细胞计数及分类:
巨噬细胞占比5%(↓),淋巴细胞占比51%(↑),中性粒细胞占比41%(↑),嗜酸粒细胞占比3%(↑)。
淋巴细胞亚群:CD4/CD8比值0.53。
NGS(DNA+RNA)阴性;结核X-pert阴性;CNV(变异拷贝数)阴性。
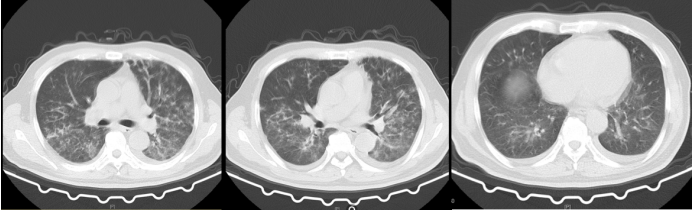
患者既往前列腺癌病史,双肺弥漫间质性病变,考虑肿瘤不能除外,遂于4月15日进一步行PET-CT(图4),结果显示:双肺多发病变,纵隔及双肺门淋巴结代谢增高,考虑炎症。前列腺代谢不均匀增高,符合前列腺癌表现。左侧耻骨及双侧坐骨骨质异常伴代谢增高,考虑转移。患者双肺病变较前快速进展(图5)。
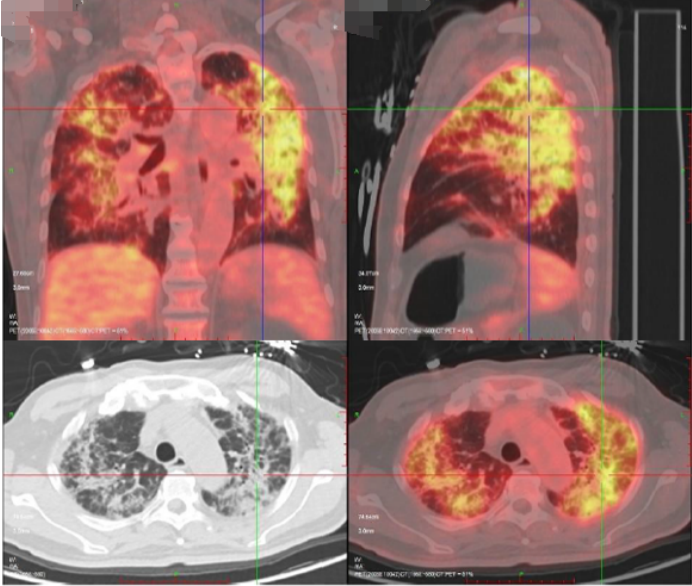
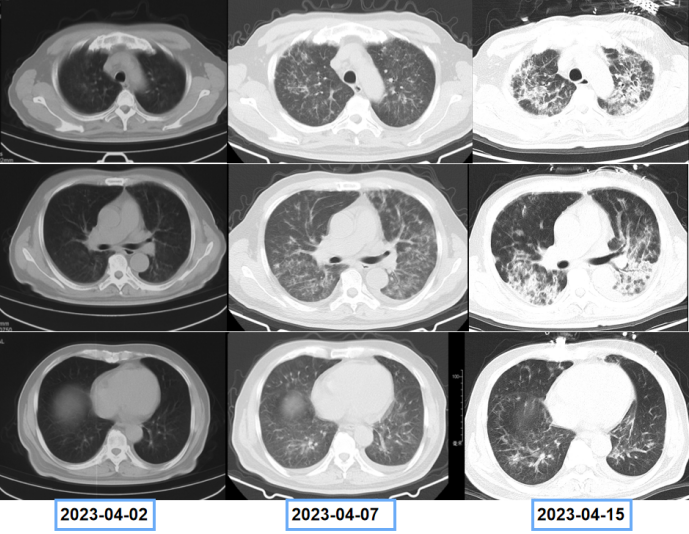
图5 患者胸部CT变化
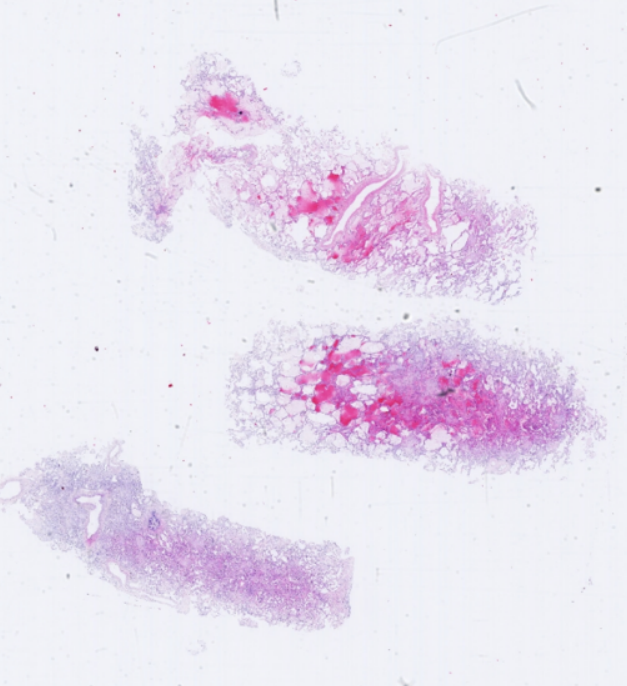
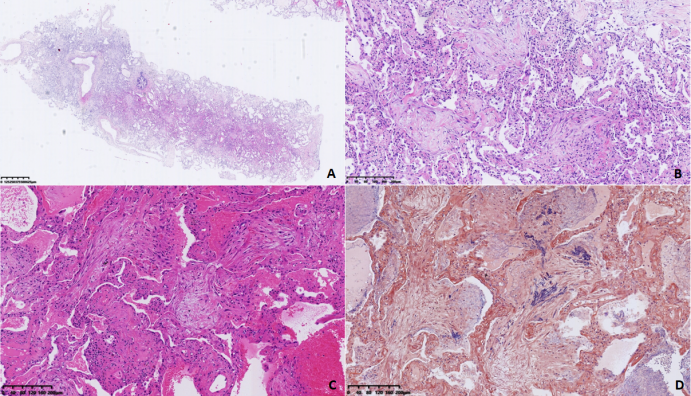
注:A、B、C均为HE染色;D为PTAH染色。
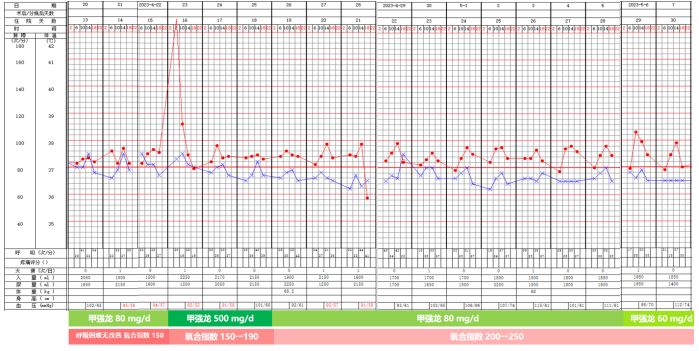
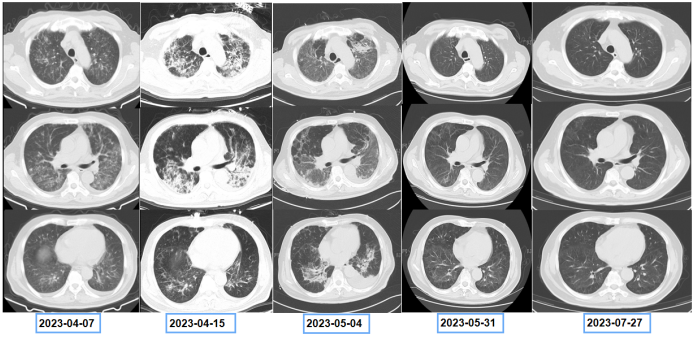
图9 复查胸部CT
四、文献复习
AFOP是特发性间质性肺炎中的一种罕见病理类型。
病因分为特发性和继发性,继发性病因主要包括感染、结缔组织疾病、药物相关、肿瘤等。
诊断:目前尚无统一的诊断标准,临床表现缺乏特异性,确诊主要依赖于组织病理学。
治疗:目前无统一的治疗方案,糖皮质激素为主要治疗药物,但缺乏统一的剂量和疗程。在大部分文献报道中,多数采用较大剂量甲强龙治疗以及口服泼尼松序贯方案。
预后:AFOP临床转归与起病方式直接相关,病死率>50%。急性爆发型AFOP多迅速进展至呼吸衰竭和多脏器功能衰竭,病死率高;亚急性AFOP病程长,与COP相似,临床应用糖皮质激素治疗大多有效,可治愈。
本例患者既往使用阿帕他胺和醋酸亮丙瑞林治疗前列腺癌。2022年3月发表的1篇研究分析了美国食品和药物管理局不良事件报告系统中2004—2020年前列腺癌患者接受内分泌治疗的间质性肺疾病(ILD)不良事件分析。结果发现,患者服用前列腺癌治疗药物阿帕他胺和亮丙瑞林与ILD的发生直接相关。Matsumoto等使用2004—2018年JADER数据分析了药物诱导的ILD,发现ILD事件与比卡鲁胺(ROR 9.2,95%CI 7.9~10.6)和亮丙瑞林之间存在显著关联(ROR 4.0,95%CI 3.5~4.7)。亮丙瑞林结果的差异可能来自不同的数据库(JADER与FAERS)、不同疑似药物识别方法(所有疑似药物与主要疑似药物),以及不同的药物组合管理方法(任何亮丙瑞林治疗与亮丙瑞琳单药治疗)。为了进一步研究亮丙瑞林与ILD事件之间的相关性,进行了以下3个子分析:亮丙瑞林单药治疗、亮丙瑞林联合治疗和亮丙瑞林单药+联合治疗;ROR和95%CI分别为:0.87(0.70~1.06)、6.75(5.60~8.13)和1.70(1.48~1.95)。因此,亮丙瑞林对ILD事件的影响应谨慎对待,可能受到其他联合治疗药物(如第一代ARAs)的影响。
阿帕他胺上市后数据提到有ILD报道。
病例1:71岁男性患者,用药3个月后出现呼吸困难,加重1个月。BALF淋巴细胞占比51%。胸部CT示双肺磨玻璃影及实变影。TBLB病理示:肺泡壁水肿增厚,淋巴细胞为主的炎症细胞浸润,间隙纤维蛋白沉积。治疗方面:停用阿帕他胺,并给予大剂量甲强龙治疗(500 mg/d,连用3天),患者呼吸状况迅速改善。甲强龙在13周内逐渐减量至5 mg。
病例2:84岁男性患者,用药3个月后出现呼吸困难,加重数日。BALF淋巴细胞占比65%。胸部CT示:双侧实变和磨玻璃影。治疗方面:入院后停用阿帕他胺,每日给予甲强龙80 mg。然而,由于进行性呼吸衰竭,患者在治疗第3天需要经鼻高流量吸氧(流量50 L/ min,FiO2 60%)。开始大剂量甲强龙治疗(500 mg/d,连用3天),患者呼吸状况逐渐改善。
上述两个病例是由日本学者报道,与我中心接诊的这例患者类似。第一个病例有TBLB病理,没有特异性,甲强龙500 mg后患者呼吸困难改善。第二个病例没有病理,入院后停用阿帕他胺,先用了甲强龙80 mg,呼吸衰竭加重,后调整为甲强龙500 mg,病情好转。
五、小结
六、点评&讨论
淦鑫教授:
AFOP总体临床发病率不高。从临床疾病进展分析,本例患者更类似于感染性疾病。在影像学方面,AFOP多以肺部实变为主,通过肺穿刺活检能够明确诊断。本例患者有前列腺癌病史,并使用了相应的药物治疗,患者的影像学从最初的磨玻璃样渗出到间质肺改变,进展迅速。两次NGS均未找到病原体,其他检查也未发现病原学方面的线索。此外,也无风湿免疫疾病相关证据。最终通过冷冻肺活检诊断了AFOP,并据此予以激素治疗,500 mg冲击治疗后,病情得到明显改善。通过该病例,我们也看到了冷冻肺活检在危重症患者诊断方面发挥的巨大作用,对临床医师有很大帮助。另外,诊断AFOP后,何种情况下会考虑激素冲击治疗?如果激素冲击治疗无效或效果不理想,还会使用其他免疫抑制剂吗?还会使用丙球吗?
郭晨霞医师:
邢丽华教授:
该患者是一位老年男性,既往有前列腺癌病史,曾接受内分泌调节治疗,此次起病的突出表现是发热以及两肺弥漫性病变,进展迅速。入院后治疗团队快速进行了相关的鉴别诊断,除了常规的病原学检测,还进行了两次肺泡灌洗及NGS检测,在BALF细胞分类中,第一次淋巴细胞占83%,第二次淋巴细胞占51%,这并不符合常见细菌感染的细胞分类。两次NGS结果均为阴性,基本排除了感染性疾病。针对非感染性疾病的相关检查指标也均为阴性。此时的诊断仍未明确。接下来采取了冷冻肺活检,为后续的诊断和治疗指明了方向。最终诊断为AFOP,以激素治疗为主。继发AFOP的原因有很多,例如感染、结缔组织病等。既往也有药物引起间质性肺病的报道,但并没有可靠的病理学依据,而本例患者直接获得了病理学证据,为后续的治疗提供了重要参考。在本病例中,激素的使用发挥了至关重要的作用,前期使用80 mg甲强龙,症状无明显缓解,加大激素用量后,病情得以改善。个人认为对于激素使用剂量并没有统一的标准,主要根据患者的临床症状缓解程度、氧合和呼吸困难改善情况以及炎症指标变化情况综合判断。
周庆涛教授:
参考文献
[1] 杨雪, 孔君, 杨明夏, 等. 21例急性纤维素性机化性肺炎临床特征分析[J]. 中华结核和呼吸杂志, 2020, 43(8):670-676.
[2] Kim M C, Kim Y W, Kwon B S, et al. Clinical features and long-term prognosis of acute fibrinous and organizing pneumonia histologically confirmed by surgical lung biopsy[J]. BMC Pulm Med, 2022, 22(1):56.
[3] Wu B, Shen P, Yin X, et al. Analysis of adverse event of interstitial lung disease in men with prostate cancer receiving hormone therapy using the Food and Drug Administration Adverse Event Reporting System[J]. Br J Clin Pharmacol. 2023 Feb;89(2):440-448.
[4] Matsui T, Umetsu R, Kato Y, et al. Adverse Event Signals of Interstitial Lung Disease in the FDA Adverse Event Reporting System (FAERS) Database and the Japanese Adverse Drug Event Report (JADER) Database[J]. Iyakuhin Johogaku, 2015, 17:145-154.
[5] Kobe H, Tachikawa R, Masuno Y, et al. Apalutamide-induced severe interstitial lung disease: A report of two cases from Japan[J]. Respir Investig, 2021, 59(5):700-705.
作者简介
 后可发表评论
后可发表评论




友情链接
联系我们
 公众号
公众号
 客服微信
客服微信